Danishefského totální syntéza taxolu
Danishefského totální syntéza taxolu je třetí známou totální syntézou taxolu, provedla ji v roce 1996 skupina vědců, kterou vedl Samuel Danishefsky,[1] dva roky po Holtonově a Nicolauově syntéze. Tyto práce vytvořily náhled do využití totální syntézy.
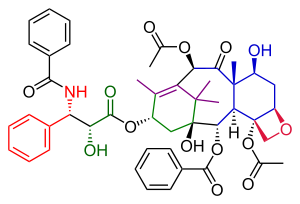
Danishefského postup přípravy taxolu se v mnohém podobá Nicolaouově. V obou případech jde o konvergentní syntézy, kde se spojují kruhy A a C vytvořené z prekurzorů. Danishefského provedení zahrnuje dokončení oxetanového kruhu D na cyklohexanolovém kruhu C před tvorbou osmičlenného kruhu B. Nejdůležitějším výchozím materiálem je zde (+) enantiomer Wielandova–Miescherova ketonu. Tato sloučenina je dostupná v enantiomerně čisté podobě a její chirální skupina může řídit posloupnost reakcí k jedinému opticky aktivnímu produktu. Konečný krok, napojení vedlejšího řetězce, je, stejně jako u Nicolaouovy syntézy, založen na Odžimově laktamu.
Při této syntéze se používají Wielandův-Miescherův keton, 2-methyl-pentan-3-on, hydrid lithnohlinitý, oxid osmičelý, fenyllithium, chlorochroman pyridinia, Coreyovo-Čajkovského činidlo a akryloylchlorid. Nejdůležitějšími přeměnami jsou zde Johnsonova–Coreyova–Čajkovského reakce a Heckova reakce.
Retrosyntéza
editovatTaxol vznikne napojením řetězce Odžimova laktamu na alkohol 51 (baccatin III, což byla původní cílová molekula Danishefského syntézy). Alkohol 51 vznikl oxidací α-acylketonu 49. Sloučenina 49 se vytvořila Heckovou reakcí enoltriflátu 38, použitého na uzavření kruhu B. Enoltriflát 38 je výsledkem přesmyku sloučeniny 31 po odstranění hydroxylové chránicí skupiny. Tato sloučenina 31 vznikla spojením kruhů A a C reakcí aldehydu 21 s vinyllithným činidlem odvozeným od kyanhydrinu 29. Tento kyanhydrin se vytvořil z ethylisopropylketonu (22). Aldehyd 21 byl získán z molekuly 17, produktu otevírání ketalu 12. Ketal 12 vznikl z Wielandova-Miescherova ketonu (1).
|
|
| Retrosyntéza |
|---|
Syntéza kruhu D
editovatNa předchozím obrázku je znázorněna syntéza oxetanového kruhu D z kruhu C, začínající u (+)-enantiomeru Wielandova-Miescherova ketonu (1). Jeho redukcí tetrahydridoboritanem sodným vzniká nenasycený ketoalkohol 2, na nějž se naváže acetátová chránicí skupina, následně se alkenovým přesmykem vytvoří ketal. Acetylová skupina se nahradí terc-butyldimethylsilylovou. Hydroborací a následnou oxidací peroxidem vodíku vznikne alkohol 5. Hydroxylová skupina byla zoxidována na karbonylovou dichromanem pyridinia a vytvořil se keton 6. Po ochránění všech citlivých funkčních skupin byla vytvořena methylenová skupina nutná pro tvorbu oxetanového kruhu D vytvořena působením Coreyova-Čajkovského činidla, což udělalo z karbonylové skupiny epoxidovou (7). Reakcí tohoto epoxidu s isopropoxidem hlinitým vznikl derivát allylalkoholu 8. Oxidací nově utvořené dvojné vazby katalytickým množstvím oxidu osmičelého za přítomnosti N-methylmorfolin-N-oxidu vznikly dva nové hydroxyly. Tento krok nebyl stereospecifický výtěžek triolu 9 se správnou stereochemií tak byl omezený. Primární alkohol byl ochráněn jako silylether a sekundární alkohol aktivován jako triflát (11). Zahříváním tohoto trimethylsilylovaného triflátu v ethylenglykolu došlo k uzavření oxetanového kruhu 12.
|
|
| Schéma 1 |
|---|
Příprava na syntézu kruhu AB
editovatV následující části (znázorněné na obrázku níže) byla 12 na cyklohexanovém kruhu vytvořena dvě místa pro spojení s kruhem A. Alkohol 12 byl ochráněn benzylovou skupinou a z ketonu byla odstraněna acetonidová chránicí skupina. Keton 14 byl přeměněn na silylenolether 15 reakcí s trimethylsilyltriflátem pozměněnou Rubottomovou oxidací dimethyldioxiranem následovanou reakcí s kyselinou kamforsulfonovou byl zaveden hydroxyl na pozici alfa vzhledem ke ketonu. Otevřením kruhu působením octanu olovičitého v methanolu se vytvořila sloučenina 17. V následujícím kroku byl aldehyd ochráněn jako dimethylacetal a esterová skupina byla zredukována na primární alkohol 18. Hydroxyl se Griecovou eliminací přeměnil na selenoether (19), z něhož oxidací peroxidem vodíku vznikl alken 20. Ozonolýzou ozonem a trifenylfosfinem se utvořil aldehyd 21.
|
|
| Příprava na syntézu kruhu AB |
|---|
Syntéza kruhu AB
editovatSyntéza kruhů A a B začala reakcí morfolinového enaminu ethylisopropylketonu s akryloylchloridem spojením nukleofilní konjugované adice a nukleofilní acylové substituce, kde po hydrolýze vznikl diketon 25. Jeho reakcí s hydrazinem v triethylaminu a s ethanolem se vytvořil hydrazon 26. Následnou hydrazonovou jodací, jodací v poloze alfa vůči karbonylu a odštěpením HI, se, poté co došlo k neočekávané dehydrogenaci, vytvořil vinyljodid 28. Keton se přeměnil na kyanhydrin 29 působením trimethylsilylkyanidu, kyanidu draselného a crownetheru.
| Syntéza kruhu AB (1) |
|---|
Spodní část kruhu B vznikla reakcí aldehydové skupiny kruhu C 21. Z ketonu byla oddělena chránicí skupina pomocí tetra-n-butylamoniumfluoridu a po epoxidaci kyselinou m-chlorperoxybenzoovou vznikl epoxid 32. Tento epoxid následně prošel hydrogenací vodíkem katalyzovanou palladiem na uhlíku, čímž se vytvořil diol 33, v dalším kroku ochráněný jako karbonátový ester (34).
Redukcí enonu 34 L-selektridem byl získán keton 35, následně převedený na vinyltriflát 36 reakcí s fenyltriflimidem a bis(trimethylsilyl)amidem draselným v tetrahydrofuranu při −78 °C. Tento vinyltriflát byl jednou ze skupin nutných pro provedení Heckovy reakce. Tvorby další reaktivní skupiny bylo dosaženo přeměnou acetalové skupiny na aldehyd 37 a jeho převedením na koncový alken 38 Wittigovou reakcí s methylentrifenylfosforanem. Vnitromolekulární Heckovou reakcí s tetrakis(trifenylfosfin)palladiem a uhličitanem draselným v refluxovaném acetonitrilu se utvořil dien 39 a kruh B byl dokončen.
| Syntéza kruhu AB (2) |
|---|
Úprava kruhu B
editovatPři druhé části syntézy kruhu B bylo potřeba, aby měl vzniklý ethylenový můstek propojující kruhy A a C správné substituenty. Po výše uvedených reakcích obsahoval exocyklickou methylenovou skupinu, v taxolu je ovšem na tomto místě α-acylketon. Potřebná přeměna byla uskutečněna v 10 krocích.
Terc-butylsilylová chránicí skupina u dienu 39 neumožňovala provedení dalších reakcí a byla nahrazena triethylsilylovou. Epoxidací dienu 40 with kyselinou meta-chloroperoxybenzoovou se vytvořil oxiranový kruh. V následujících dvou krocích došlo k výměně benzylové chránicí skupiny u sloučeniny 41 za acetyl. Ester 43 byl otevřen reakcí s fenyllithiem, čímž vznikl alkohol 44. Štěpení exocyklické dvojné vazby bylo obtížné a vyžadovalo použití 19 ekvivalentů oxidu osmičelého (při teplotě 105 °C a době reakce 24 hodin, výsledkem byl osmátový ester 45. Následným oxidačním štěpením octanem olovičitým se vytvořil meziprodukt 46. Odstranění epoxidové chránicí skupiny proběhlo za přítomnosti jodidu samarnatého[2], vytvořil se tím α-ß-nenasycený keton 47. Reakcí tohoto ketonu s terc-butoxidem draselným, reakcí s anhydridem kyseliny fenylseleninové a acylací vznikl α-acylketon 49.
|
|
| Úprava kruhu B |
|---|
Navázání postranního řetězce
editovatNavázání postranního řetězce taxolu zde proběhlo stejně jako u Nicolaouovy syntézy prostřednictvím Odžimova laktamu. Kruh A byl funkcionalizován hydroxylovou skupinou pomocí oxidace α-acylketonu 49 chlorochromanem pyridinia na keton 50, poté se redukcí tetrahydridoboritanem sodným utvořil alkohol 51 . Reakcí tohoto alkoholu s Odžimovým laktamem 52 a odštěpením dvou triethylsilylových chránicích skupin u sloučeniny 53 vznikl taxol.
|
|
| Navázání postranního řetězce taxolu |
|---|
Chránicí skupiny
editovatAcetát
editovatNavázání: acetanhydrid, 4-(dimethylamino)pyridin a pyridin
Odstranění: ethoxid sodný, ethanol
Hydroxylová skupina u alkoholu 3 byla ochráněna jako acetát před alkenovým přesmykem. Acetát byl odstraněn tert-butyldimethylsilylovou skupinou (keton 6).
Acetonid
editovatNavázání: ethylenglykol, kyselina naftalensulfonová
Odstranění: kyselina p-toluensulfonová, aceton, voda
Keton 3 byl ochráněn pomocí acetonidové skupiny, odstraněné po vzniku kruhu D (keton 14).
Benzyl
editovatNavázání: benzylchlorid, pyridin
Odstranění: acetanhydrid, 4-(dimethylamino)pyridin, pyridin
Hydroxylová skupina ketalu 12 byla ochráněna jako benzylether, odstraněný mnohem později (alkohol 42)
Cyklický karbonátový ester
editovatNavázání: karbonyldiimidazol, hydrid sodný, dimethylformamid
Odstranění: fenyllithium
Diol 33 byl ochráněn jako cyklický karbonát. Reakcí tohoto karbonátu s fenyllithiem byla odstraněna chránicí skupina z jednoho hydroxylu a zůstal benzoyl na dalším kyslíku (alkohol 44).
Dimethylacetal
editovatNavázání: methanol, kolidinium-p-toluensulfonát
Odstranění: pyridiniumtosylát
Karbonylová skupina aldehydu 17 byla ochráněna dimethylacetalem, aby mohlo proběhnout navázání kruhu A na kruh C. Aldehyd byl později odstraněn pyridiniumtosylátem.
Epoxid
editovatNavázání: kyselina m-chlorperoxybenzoová
Odpojení: jodid samarnatý, acetanhydrid, tetrahydrofuran
Jedna z dvojných vazeb dienu 39 byla ochráněna tvorbou epoxidu v rámci přípravy na pozměňování druhé. Epoxid byl po 4 krocích odstraněn jodidem samarnatým.
Terc-butyldimethylsilyl
editovatNavázání: terc-butyldimethylsilylchlorid, lutidin
Odstranění: tetra-n-butylamoniumfluorid, tetrahydrofuran
Acetylová chránicí skupina nutná pro acetylaci enonu 3 byla nahrazena terc-butyldimethylsilylovou, jejíž odstranění následovalo mnohem později, za účelem snadnějšího odstranění chránicí skupiny před závěrečnou částí syntézy (sloučenina 40).
Triethylsilyl [1]
editovatNavázání: triethylsilyltriflát, triethylamin, dichlormethan.
Odstranění: kyselina fluorovodíková, pyridin, acetonitril
Triethylsilyl nahradil terc-butylsilylovou skupinu (sloučenina 40. Jeho odstranění bylo provedeno v posledním kroku, kde vznikl výsledný produkt.
Triethylsilyl [2]
editovatNavázání: Viz: Odžimův laktam
Odstranění: kyselina fluorovodíková, pyridin, acetonitril
Triethylsilylová skupina na Odžimově laktamu byla odstraněna v posledním kroku.
Trimethylsilyl
editovatNavázání: trimethylsilylkyanid, kyanid draselný, crown ether
Odstranění: tetra-n-butylamoniumfluorid
Keton dienu 28 byl ochráněn trimethylsilylem, jenž se oddělil od vinyllithiové skupiny sloučeniny 30 při navázání kruhu A na aldehyd kruhu C (21).
Odkazy
editovatSouvisející články
editovat- Totální syntéza taxolu
- Mukaijamova totální syntéza taxolu
- Holtonova totální syntéza taxolu
- Kuwadžimova totální syntéza taxolu
- Nicolaouova totální syntéza taxolu
- Wenderova totální syntéza taxolu
- Takahašiova totální syntéza taxolu
Externí odkazy
editovatReference
editovatV tomto článku byl použit překlad textu z článku Danishefsky Taxol total synthesis na anglické Wikipedii.
- ↑ Samuel J. Danishefsky, John J. Masters, Wendy B. Young, J. T. Link, Lawrence B. Snyder, Thomas V. Magee, David K. Jung, Richard C. A. Isaacs, William G. Bornmann, Cheryl A. Alaimo, Craig A. Coburn, Martin J. Di Grandi. Total Synthesis of Baccatin III and Taxol. Journal of the American Chemical Society. 1996, s. 2843–2859. DOI 10.1021/ja952692a.
- ↑ Molander, G. "Application of lanthanide reagents in organic synthesis" Chemical Reviews 1992, 92 (1), 29–68 DOI:10.1021/cr00009a002