Methan
Methan (mimo chemii dle PČP metan) neboli podle systematického názvosloví karban je nejjednodušší alkan, a tedy i nejjednodušší stabilní uhlovodík vůbec. Při pokojové teplotě je to netoxický plyn bez barvy a zápachu, lehčí než vzduch (relativní hustota 0,55 při 20 °C).
| Methan | |
|---|---|
 Strukturní vzorec | |
 Tyčinkový model | |
 Kalotový model | |
| Obecné | |
| Systematický název | methan |
| Triviální název | bahenní plyn |
| Ostatní názvy | metan |
| Sumární vzorec | CH4 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 74-82-8 |
| EC-no (EINECS/ELINCS/NLP) | 200-812-7 |
| Indexové číslo | 601-001-00-4 |
| Vlastnosti | |
| Molární hmotnost | 16,042 6 g/mol |
| Teplota tání | −182,5 °C |
| Teplota varu | −161,6 °C |
| Hustota | 0,676 kg/m3 (plyn, 21 °C, 1 013 hPa) 0,422 62 g/cm3 (kapalina, −161,6 °C, 1 013 hPa) |
| Kritická teplota Tk | −82,7 °C |
| Kritický tlak pk | 4,596 MPa |
| Rozpustnost ve vodě | 0,22 mg/l (20 °C) |
| Struktura | |
| Dipólový moment | 0 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H220 |
| R-věty | R12 |
| S-věty | (S2) S9 S16 S33 |
| NFPA 704 |  4
1
0
|
| Teplota vzplanutí | −188 °C |
| Teplota vznícení | 600 °C |
| Meze výbušnosti | 5–15 % |
Některá data mohou pocházet z datové položky. | |

Příprava
editovatHlavním zdrojem methanu je přírodní surovina zemní plyn. Přímá příprava sloučením uhlíku s vodíkem je prakticky nemožná, vzhledem k tomu, že by uhlík musel být nejprve převeden do plynného stavu. Teoreticky však lze methan připravit dvoustupňovou syntézou přes sirouhlík
- C + 2 S → CS2,
který pak reakcí se sulfanem (sirovodíkem) a mědí dá methan
- CS2 + 2 H2S + 8 Cu → CH4 + 4 Cu2S.
Jinou možností je reakce karbidu hliníku s vodou
- Al4C3 + 12 H2O → 3 CH4 + 4 Al(OH)3.
Laboratorně se dá připravit žíháním směsi octanu sodného s hydroxidem sodným (natronovým vápnem)
- CH3COONa + NaOH → CH4 + Na2CO3.
Vlastnosti
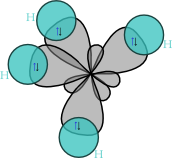
editovatMolekula methanu má symetrii pravidelného čtyřstěnu (bodová grupa symetrie Td), v jehož těžišti se nachází uhlíkový atom a v jehož vrcholech se nacházejí vodíkové atomy. Díky této vysoké symetrii je celkově molekula methanu nepolární, přestože vazby H–C slabou polaritu vykazují.
Methan může reagovat explozivně s kyslíkem
CH4 + 2 O2 → CO2 + 2 H2O.
Bod samozážehu je sice velmi vysoký (595 °C, teplota vznícení při koncentraci 8,5 % je 537 °C), ale stačí např. elektrická jiskra nebo otevřený plamen a směs methanu se vzduchem může být přivedena k výbuchu (minimální iniciační energie je 0,28 mJ). Přitom meze výbušnosti jsou značně velké, od 4,4 do 15 objemových procent. Proto je nezbytně nutné průběžně sledovat koncentraci methanu (důlního plynu) v uhelných dolech, aby se předešlo katastrofám. Podobně prudce může methan reagovat i s plynným chlorem, je-li reakce iniciována prudkým zahřátím. Za normální teploty probíhá pomalu čtyřstupňově za vzniku chlorovaných derivátů methanu
- CH4 + Cl2 → CH3Cl + HCl,
- CH3Cl + Cl2 → CH2Cl2 + HCl,
- CH2Cl2 + Cl2 → CHCl3 + HCl,
- CHCl3 + Cl2 → CCl4 + HCl.
Podobně reaguje i s jinými halogeny. Jinak je málo reaktivní.
- Dokonalé hoření methanu
- CH4 + 2O2 → CO2 + 2H2O
- Nedokonalé hoření methanu
- CH4 + O2 → 2H2O + C, nebo
- 2CH4 + 3O2 → 4H2O + 2CO
Výskyt v přírodě
editovatMethan se přirozeně vyskytuje na Zemi:
- v atmosféře, kam se dostává zejména jako produkt rozkladu látek biogenního původu (bioplyn), nebo jako produkt metabolismu velkých přežvýkavců, také z termitišť a z rýžovišť.
- v podzemí:
- jako hlavní složka zemního plynu
- jako součást důlního plynu v dolech
- rozpuštěný v ropě
- rozpuštěný ve vodě některých jezer, zvláště v Africe (např. jezero Kivu mezi Rwandou a Kongem)
- tvoří bublinky pod ledem rozmrzajícího permafrostu, například na Sibiři
Přítomnost ve vesmíru
editovatVe vesmíru byl nalezen v plynných mračnech v mezihvězdném prostoru.
Dále je obsažen v atmosférách velkých planet (Jupiter, Saturn, Uran a Neptun) sluneční soustavy. V pevném stavu je součástí tzv. ledových měsíců velkých planet a tvoří zřejmě nezanedbatelnou část hmoty transneptunických těles, případně je vysrážen ve formě ledu nebo jinovatky na jejich povrchu (např. Pluto). Byl také prokázán v komách komet.
Původ na Zemi
editovatNa Zemi pochází asi 90 % metanu z produkce živých organismů, menší část vzniká při geologických aktivitách (např. tavením magmatu).
Ve vesmíru však bez dalších podkladů nelze původ metanu prokázat.[2] Zprávy některých médií, které z objevu metanu usuzují na existenci života ve vesmíru, jsou proto považovány za nepodložené.[3]
Použití
editovatHlavní oblastí použití methanu je energetika, kde slouží ve směsi s jinými uhlovodíky jako plynné palivo. V automobilové dopravě představuje jednu z pohonných látek, pod označením CNG (Compressed Natural Gas), stlačený zemní plyn, jehož hlavní složku tvoří právě methan.
Methan je spolu s kyslíkem používán jako palivo pro raketové motory vesmírné lodi Starship.[4]
V chemickém průmyslu se používá především k výrobě oxidu uhličitého dokonalým spalováním se vzduchem a při nedokonalém spalování k výrobě sazí používaných jako plnidlo a barvivo v gumárenském průmyslu. Pyrolýzou (tepelným rozkladem) za nepřístupu vzduchu se vyrábí ethyn (acetylen) a vodík.
Ekologické účinky
editovatVzhledem k tomu, že methan silně absorbuje infračervené záření, patří mezi významné skleníkové plyny zvyšující teplotu zemské atmosféry (je přibližně 20krát účinnější než oxid uhličitý, ale jeho obsah v atmosféře je oproti tomu asi 200krát menší než u oxidu uhličitého: 0,0002 % methanu a 0,04 % oxidu uhličitého, takže jeho vliv je přibližně 10krát menší).[pozn. 1]
Produkují ho hlavně mokřady, dále hospodářská zvířata a v menší míře průmysl a skládky.[5] Významným producentem jsou ale i jezera[6] a fjordy.[7] Byly objeveny i další zdroje: mořští mlži,[8][9] či některé ledovce.[10] Produkují ho i stromy.[11] Zhruba polovina emisí methanu je z vodních ekosystémů.[12] Studie dříve uvažovaly, že vlivem globálního oteplování se bude methan uvolňovat i z oceánu[13] či tundry; nejnovější výzkumy však ukazují, že tomu tak být nemusí.[14] Uvolňování metanu se také nadhodnocovalo.[15]
Methan je v atmosféře oxidován především působením hydroxylových radikálů. Dosavadní scénáře budoucího vývoje klimatu vycházejí z představy, že spolu s nárůstem koncentrace metanu bude v množství hydroxylových radikálů v atmosféře ubývat. Dlouhodobé sledování troposféry podalo důkaz, že koncentrace radikálu OH neklesají.[16] Jeho molekuly opětovně vznikají působením slunečního záření. Jedním zdrojem jsou oxidy dusíku, druhým pak vodní pára a ozon za přispění ultrafialového záření v nižších vrstvách atmosféry.
Odkazy
editovatPoznámky
editovat- ↑ Pro přehled účinnosti skleníkových plynů viz tabulka v hesle skleníkové plyny
Reference
editovat- ↑ a b Methane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ BRANDEJSKÁ, Anna. Vědci znovu objevili metan na Marsu, mohl by znamenat život [online]. iDnes, 2009-01-15 [cit. 2009-01-18]. Dostupné online.
- ↑ KUBALA, Petr. Metan na Marsu není téma pro bulvár [online]. Česká astronomická společnost, 200-01-16 [cit. 2009-01-18]. Dostupné online.
- ↑ MELECHIN, Petr. Vše o Starship [online]. 2019-01-26 [cit. 2022-01-10]. Dostupné online.
- ↑ PAZDERA, Josef. Dobytek otepluje Zemi více, než ropný těžařský průmysl s plynárenským dohromady. osel.cz [online]. 2014-07-15 [cit. 2023-01-13]. Dostupné online.
- ↑ PURCHASE, Delyth. Study shows lake methane emissions should prompt rethink on climate change. phys.org [online]. 2019-12-04 [cit. 2023-01-13]. Dostupné online. (anglicky)
- ↑ University of Gothenburg. Fjords may emit as much methane as all the deep oceans globally. phys.org [online]. 2022-05-27 [cit. 2023-01-13]. Dostupné online. (anglicky)
- ↑ Baltic Sea clams 'giving off as much gas as 20,000 cows'. BBC News [online]. 2017-10-13 [cit. 2023-01-13]. Dostupné online. (anglicky)
- ↑ NASCIMENTO, Francisco J. A.; FRU, Ernest Chi; ALESSANDRA VICENZI. Methane fluxes from coastal sediments are enhanced by macrofauna. Scientific Reports. 2017-10-13, roč. 7, čís. 1, s. 1–10. Dostupné online [cit. 2019-08-12]. ISSN 2045-2322. DOI 10.1038/s41598-017-13263-w. PMID 29030563. (anglicky)
- ↑ PAZDERA, Josef. Oteplují ledovce planetu? Některé ano!. osel.cz [online]. 2018-11-27 [cit. 2023-01-13]. Dostupné online.
- ↑ JEFFREY, Luke. Methane-eating bacteria found in a common tree is possible game-changer for curbing greenhouse gases. sciencex.com [online]. [cit. 2023-01-13]. Roč. 2021-04-09. Dostupné online. (anglicky)
- ↑ ROSENTRETER, Judith. Half of global methane emissions come from aquatic ecosystems—much of it human-made. sciencex.com [online]. 2021-04-06 [cit. 2023-01-13]. Dostupné online. (abgkucjy)
- ↑ Study finds hydrate gun hypothesis unlikely. phys.org [online]. 2017-08-23 [cit. 2023-01-13]. Dostupné online. (anglicky)
- ↑ Oregon State University. Methane from tundra, ocean floor didn't spike during previous natural warming period. phys.org [online]. 2017-08-23 [cit. 2023-01-13]. Dostupné online. (anglicky)
- ↑ Center for Arctic Gas Hydrate, Climate and Environment. Climate gas budgets highly overestimate methane discharge from Arctic Ocean. phys.org [online]. 2020-01-13 [cit. 2023-01-13]. Dostupné online. (anglicky)
- ↑ PAZDERA, Josef. Čistič skleníkových plynů se recykluje. osel.cz [online]. 2018-12-03 [cit. 2023-01-13]. Dostupné online. (anglicky)
Literatura
editovat- Ibler Z. a kol.: Energetika technický průvodce, 2002 BEN - technická literatura, ISBN 80-7300-026-1
Související články
editovatExterní odkazy
editovat- Obrázky, zvuky či videa k tématu methan na Wikimedia Commons
- Slovníkové heslo metan ve Wikislovníku
- Encyklopedické heslo Methan v Ottově slovníku naučném ve Wikizdrojích
- Methane, CH4, Physical properties, safety
- Umweltlexikon Archivováno 16. 3. 2005 na Wayback Machine.
- Metanová časovaná bomba (o ekologických účincích metanu)
