Oxid arsenitý
Oxid arsenitý, známý také pod triviálním názvem arsenik nebo otrušík, případně pod staršími českými jmény utrejch nebo utrých, je nejběžnější oxid arsenu. Setkáváme se s ním nejčastěji v podobě bílého krystalického nebo amorfního prášku nebo hrudek. Jedná se o látku bez zápachu, velmi toxickou. Arsen má rovněž karcinogenní účinky, tudíž může při dlouhodobé otravě dojít k rozvoji nádorů, např. rakoviny kůže, plic nebo jater.
| Oxid arsenitý | |
|---|---|
 | |
Strukturní vzorec dimeru | |
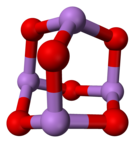 Prostorový vzorec oxidu arsenitého | |
| Obecné | |
| Systematický název | Oxid arsenitý |
| Triviální název | Arsenik Otrušík |
| Ostatní názvy | Utrejch Utrých |
| Anglický název | Arsenic trioxide |
| Německý název | Arsen(III)-oxid |
| Sumární vzorec | As4O6 |
| Vzhled | Bílá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 1327-53-3 |
| EC-no (EINECS/ELINCS/NLP) | 215-481-4 |
| PubChem | 518740 |
| Vlastnosti | |
| Molární hmotnost | 197,841 5 g/mol (As2O3) 395,682 8 g/mol (As4O6) |
| Teplota tání | 278 °C (modifikace α) 314 °C (modifikace β) |
| Teplota varu | 457,2 °C (modifikace α) 457,2 °C (modifikace β) |
| Teplota sublimace | 193 °C (modifikace γ) |
| Hustota | 3,865 g/cm3 (modifikace α, 25 °C) 4,15 g/cm3 (modifikace β, 25 °C) 3,738 (modifikace γ) |
| Tvrdost | 1,5 |
| Disociační konstanta pKa | 9,2 |
| Rozpustnost ve vodě | 1,21 g/100 ml (0 °C) 2,047 g/100 ml (25 °C) 2,93 g/100 ml (40 °C) 4,4 g/100 ml (60 °C) 5,6 g/100 ml (75 °C) 8,16 g/100 ml (98,5 °C) (modifikace α) 3,738 g/100 ml (20 °C) 10,14 g/100 ml (100 °C) (modifikace γ) |
| Měrná magnetická susceptibilita | −2,978×10−6 cm3g−1 |
| Struktura | |
| Krystalová struktura | krychlová (modifikace α) jednoklonná (modifikace β) amorfní (modifikace γ) |
| Hrana krystalové mřížky | a= 1 107,44 (modifikace α) a:b:c = 0,409:1:0,349 (modifikace β) |
| Dipólový moment | 0 D |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −1 334,7 kJ/mol (modifikace α) −1 331,6 J/mol (modifikace β) |
| Entalpie tání ΔHt | 122,6 J/g (modifikace α) 141,8 J/g (modifikace β) |
| Entalpie varu ΔHv | 114 J/g (modifikace α) 141,8 J/g (modifikace β) |
| Standardní molární entropie S° | 233,5 JK−1mol−1 (modifikace α) 245 JK−1mol−1 (modifikace β) |
| Standardní slučovací Gibbsova energie ΔGf° | −1 176,4 kJ/mol (modifikace α) −1 178,8 J/mol (modifikace β) |
| Izobarické měrné teplo cp | 0,516 JK−1g−1 (25 °C, modifikace α) 0,561 JK−1g−1 (25 °C, modifikace β) |
| Bezpečnost | |
| R-věty | R45, R28, R34, R50/53 |
| S-věty | S53, S45, S60, S61 |
| NFPA 704 |  0
3
2
|
Některá data mohou pocházet z datové položky. | |
Příprava a vlastnosti
editovatPřipravuje se oxidací kovového práškového arsenu vzdušným kyslíkem při zahřívání na vyšší teplotu:
- 4 As + 3 O2 → As4O6
případně žíháním arsenových rud za přístupu vzduchu, např. arsenopyritu:
- 4 FeAsS + 10 O2 → 2 Fe2O3 + As4O6 + 4 SO2
přičemž čistý oxid arsenitý sublimuje při teplotě 315 °C (za normálního tlaku).
Oxid arsenitý se vyskytuje ve třech modifikacích: krystalizuje jednak v krychlové, jednak v jednoklonné soustavě, nebo jako amorfní forma. V roztoku a v plynné fázi se vyskytuje v dimerní formě (viz tabulka); teprve při zahřátí par nad 1800 °C se mění v monomerní formu sumárního vzorce As2O3. Je slabě rozpustný ve vodě a dobře rozpustný v kyselině chlorovodíkové za vzniku chloridu arsenitého:
- As4O6 + 12 HCl → 4 AsCl3 + 6 H2O
Oxid arsenitý je amfoterní, tzn. rozpouští se v kyselinách i v silných zásadách, např. hydroxidu draselném za vzniku solí kyseliny arsenité, arsenitanů, v tomto případě arsenitanu tridraselného:
- As4O6 + 12 KOH → 4 K3AsO3 + 6 H2O
Kyslíkem se dále oxiduje na oxid arseničný:
- As4O6 + 2 O2 → As4O10
V přírodě se oxid arsenitý nachází ve formě minerálů arsenolitu, tzv. arsenový květ (krychlová modifikace) a claudetitu (jednoklonná modifikace).
Použití
editovatV minulosti nacházel velmi široké uplatnění:
- příprava jiných sloučenin arsenu v anorganické a organické chemii
- výroba skla (čeření skla)
- výroba emailů a barev (tzv. arseniková zeleň)
- konzervace kůže a dřeva
- jako součást jedů na hlodavce (rodenticidy)
- jako součást prostředků pro hubení roztočů (akaricidy)
Oxid arsenitý se v současnosti již k těmto účelům nevyužívá, zejména z důvodu jeho toxicity, karcinogenity a nepříznivého vlivu na přírodní prostředí.
Otrava arsenikem
editovatOtrava arsenikem je nejčastějším případem otravy sloučeninami arsenu. Přibližně 1000 let byl arsenik užíván jako jed na hlodavce, protože je bezbarvý, bez chuti a zápachu. Na přelomu 19. a 20. století byl užíván v medicíně jako Fowlerův roztok (Liquor Kalii arsenicosi) v jednoprocentní směsi s uhličitanem draselným, zejména k léčení kožních onemocnění. Při předávkování tento koktejl způsoboval vleklou (chronickou) otravu.
Smrt nastává po požití 0,3 g arseniku (s ohledem na individuální stav osoby). Při dostatečně velké dávce nastává smrt během několika hodin. Smrtná dávka (LD50) je 20 mg/kg.[zdroj?]
Příznaky otravy
editovatPříznaky akutní otravy jsou bolest břicha, nucení ke zvracení a třes. Při požití menší dávky nebo při vleklé otravě nastupují příznaky apatie, zvracení, průjem, později dehydratace, selhání ledvin. Pokud postižená osoba přežije toto období, dochází k trvalému poškození jater a nervového systému (polyneuropatie).
Jinými běžnými příznaky vleklé otravy jsou:
- kožní změny
- zánět středního ucha
- bolesti břicha
- průjmy
- poruchy periferní cirkulace krve
- úbytek míšní hmoty
- padání vlasů
- pruhy na nehtech a jejich lámavost
V místech, kde byly podzemní vody, užívané jako zdroj pitné vody, bohaté na sloučeniny arsenu, je známo, že organismus místních obyvatel si na nadměrný přísun arsenu do těla zvykl a projevy chronické otravy se buď neprojevily vůbec, nebo byly jen velmi mírné. Dnes je tento jev díky chemické kontrole zdrojů vody velmi vzácný. Může se však objevit tam, kde nebylo správně naloženo s uzavřenými důlními díly; příkladem může být výskyt arsenu ve vodě a půdě u Kutné Hory jako důsledek unikající vody z bývalého dolu na Kaňku.[1]
Léčení
editovat- vypumpování žaludku s dodatkem magnesia
- podání protijedu metallorum Sautera
- léčení následného porušení elektrolytické rovnováhy těla, nízkého krevního tlaku aj.[2]
Regulace
editovatV lednu 2010 byl Evropskou agenturou pro chemické látky zařazen na kandidátský seznam nebezpečných látek vzbuzujících mimořádné obavy pro autorizaci dle směrnice REACH.[3]
Reference
editovat- ↑ Výsledky screeningu možné zátěže arsenem a kadmiem obyvatel Kutné Hory provedené v listopadu 2000 v Malíně. www.mu.kutnahora.cz [online]. [cit. 2010-07-22]. Dostupné v archivu pořízeném dne 2016-03-04.
- ↑ ŠÁLENÝ, Jiří. Kovy 5. A skupiny [online]. Říjen 2012 [cit. 2022-06-03]. Dostupné online.
- ↑ Miroslav Šuta: REACH: 14 nebezpečných chemických látek přidáno na "černou listinu" Archivováno 24. 9. 2020 na Wayback Machine., respekt.cz, 24. ledna 2010
Literatura
editovat- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu oxid arsenitý na Wikimedia Commons

