Karbometalace
Karbometalace jsou reakce, při kterých vazby uhlík-kov reagují s vazbami pí mezi uhlíkovými atomy za vzniku nových σ vazeb uhlík-uhlík a uhlík-kov.[1]
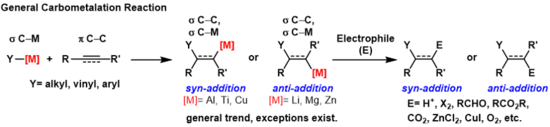
Vzniklé vazby uhlík-kov mohou vstoupit do dalších reakcí, jako jsou Zieglerovy-Nattovy polymerizace, nebo reagovat s elektrofily, například halogenačními činidly, karbonylovými sloučeninami, kyslíkem nebo anorganickými solemi za tvorby dalších organokovových sloučenin. Karbometalace lze provádět na alkynech a alkenech, kde se dosahuje vysoké geometrické či enantiomerní selektivity. Některé kovy převážně vytváří anti-produkty a u jiných vznikají hlavně syn-produkty. Zda proběhne syn- nebo anti- adice, závisí na mechanismu karbometalace.
Karboaluminace
editovatKarboaluminační reakce, při kterých se navazuje hliník, jsou nejčastěji katalyzovány zirkonocendichloridem a podobnými sloučeninami; v některých případech se místo nich používají komplexy odvozené od titanocendichloridu.[1] Tato reakce se někdy označuje jako ZACA (asymetrická karboaluminace alkenů katalyzovaná zirkoniem) nebo ZMA (methylaluminace alkynů katalyzovaná zirkoniem).[2]
Nejběžnějšími trialkylhlinitými sloučeninami zapojovanými do této přeměny jsou trimethylhliník, triethylhliník a triisobutylhliník. Pokud tyto trialkylhliníky obsahují beta-hydridy, tak se objevují vedlejší reakce v podobě eliminací a hydroaluminací. Obecný mechanismus ZMA reakce začíná tvorbou aktivního katalyzátoru z prekatalyzátoru, zirkonocendichloridu, jeho reakcí s trimethylhliníkem. Nejprve proběhne transmetalace a methyl se přesune od hliníku na zirkonium. Následně dojde k odštěpení chloridu hliníkem a vzniku kationtové sloučeniny zirkonia, úzce spojené s aniontovým komplexem hliníku. Tento kation se koordinuje na alken nebo alkyn, kde proběhne migrační inserce methylové skupiny. Vzniklá vinyl- nebo alkylzirkoniová sloučenina může vstoupit do vratné transmetalace (zachovávající stereochemii) s organohlinitou sloučeninou za vzniku konečného produktu a obnovy katalyzátoru. Tento proces většinou patří mezi syn-adice; za určitých podmínek ale může dojít i k anti-adici, která má odlišný mechanismus.
Trimethylsilylované alkyny, trimethylgermaniumalkyny a koncové alkyny mohou za pokojové či vyšší teploty vytvořit produkty anti-karboaluminačních reakcí, pokud mají navázanou koordinující skupinu do blízkosti substrátu.[3]
U těchto reakcí proběhne nejprve syn-karboaluminace výše uvedeným mechanismem. Poté další ekvivalent hliníku, s navázanou řídicí skupinou, odštěpí vinylhliník, čímž se obrátí geometrie na uhlíku, na kterém reakce probíhá.
Tímto vznikne termodynamicky výhodný metalocyklus, který brání další inverzi. Takto vzniká produkt anti-karboaluminace, který může reagovat s elektrofily. Uvedený postup je omezen tím, že řídicí skupina musí být dostatečně blízko k π vazbě uhlík-uhlík, aby se utvořil termodynamicky výhodný kruh nebo směs geometrických izomerů.
Karboaluminace alkenů za vzniku substituovaných alkanů může být enantioselektivní, jestliže se použijí prochirální alkeny. U takových reakcí se dosahuje enantioselektivity pomocí chirálního indenylového komplexu vzniklého ze zirkoniového katalyzátoru. Vysoké enantioselektivity zde lze dosáhnout u mnoha různých trialkylhlinitých sloučenin, výtěžek se ovšem s rostoucím počtem uhlíkových atomů na alkylovém řetězci trialkylhlinitého činidla snižuje.[2]
Karbolithiace
editovatPři karbolithiacích se na vazby C-C navazují organolithné sloučeniny. Lze zde použít komerčně dostupná organolithná činidla, jako je n-butyllithium, ale i sloučeniny vytvořené deprotonacemi či lithium-halogenovými výměnami.[4][5]
Jsou popsány jak mezimolekulární, tak i vnitromolekulární karbolithiace. Organolithné sloučeniny jsou vysoce reaktivní a ty, které vzniknou karbolithiacemi, tak mohou dále reagovat s elektrofily či se zbytky výchozího materiálu (což vede k polymerizacím).[4] Tento druh reakce lze provést enantioselektivně s použitím sparteinu, který chelatuje lithné ionty a vytváří chiralitu.[4][6][7] Tento postup není běžný, protože přírodní spartein je špatně dostupný. Pokroky v syntéze sparteinu a jeho využití při karbolithiacích ovšem obnovily zájem o výzkum této oblasti.[8]
Do tohoto druhu reakcí patří i alternativní syntéza tamoxifenu, vyvcházející z difenylacetylenu a ethyllithia:[9] Elektrofilem je tu triisopropylborát, který vytváří boronovou kyselinu R–B(OH)2. Ve druhém kroku vznikne tamoxifen pomocí Suzukiovy reakce.
Důsledkem silné zásaditosti, vysoké reaktivity a nukleofility organolithných sloučenin je to, že rozsah použitelných substrátů je omezen na molekuly neobsahující kyselé nebo elektrofilní funkční skupiny.
Karbomagnesiace a karbozinkace
editovatVzhledem k nižší nukleofilitě Grignardových a organozinečnatých činidel se nekatalyzované karbomagnesiace a karbozinkace obvykle objevují pouze u aktivovaných nebo sterickými a elektronovými efekty zatížených alkenů a alkynů;[10] například musí být s π-systémy vazeb C-C konjugovány skupiny odtahující elektrony, jako jsou estery, nitrily a sulfony (viz Michaelovu reakci) nebo musí být navázána řídicí skupina, například alkohol nebo amin, do jeho blízkosti.
Tyto reakce lze katalyzovat řadou různých kovů, jako jsou železo,[10][11] měď,[10] zirkonium,[12] nikl[10][13] a kobalt.[14]
Příkladem může být reakce methylfenylacetylenu s fenylmagnesiumbromidem katalyzovaná Fe, jejímž meziproduktem je vinylmagnesiová sloučenina. Hydrolýzou tohoto meziproduktu vzniká difenylalken.[11]
Grignardovo činidlo zde reaguje s acetylacetonátem železitým a tributylfosfinem a vytváří se arylželezitý meziprodukt, jenž reaguje s chloridem měďným na měďnan:
Karbopalladace
editovatKarbopalladace jsou součástmi Mizorokiových-Heckových reakcí, katalyzovaných palladiem[15] a řadit k nim lze také karbometalace využívající palladiové katalyzátory, jako jsou například difunkcionalizace[16] a hydrofunkcionalizace alkenů.[17][18]
Reference
editovatV tomto článku byl použit překlad textu z článku Carbometalation na anglické Wikipedii.
- ↑ a b Ei-ichi Negishi; Ze Tan. Diastereoselective, Enantioselective, and Regioselective Carboalumination Reactions Catalyzed by Zirconocene Derivatives. Topics in Organometallic Chemistry. 2005, s. 139–176. ISBN 9783540314523. DOI 10.1007/b96003.
- ↑ a b Shiqing Xu; Ei-ichi Negishi. Zirconium-Catalyzed Asymmetric Carboalumination of Unactivated Terminal Alkenes. Accounts of Chemical Research. 2016-10-18, s. 2158–2168. ISSN 0001-4842. DOI 10.1021/acs.accounts.6b00338. PMID 27685327.
- ↑ Shengming Ma; Ei-ichi Negishi. Anti-Carbometalation of Homopropargyl Alcohols and Their Higher Homologues via Non-Chelation-Controlled Syn-Carbometalation and Chelation-Controlled Isomerization. The Journal of Organic Chemistry. 1997-02-01, s. 784–785. ISSN 0022-3263. DOI 10.1021/jo9622688.
- ↑ a b c Donal F. O’Shea; Anne-Marie L. Hogan. Synthetic applications of carbolithiation transformations. Chemical Communications. 2008-08-18, s. 3839–3851. Dostupné online. ISSN 1364-548X. DOI 10.1039/B805595E. PMID 18726011.
- ↑ Graciela V. García; Norma Sbarbati Nudelman. Tandem Reactions Involving Organolithium Reagents. A Review. Organic Preparations and Procedures International. 2009-02-11, s. 445–500. DOI 10.1080/00304940309355860.
- ↑ Stephanie Norsikian; Ilan Marek; Jean-F. Normant. Enantioselective Carbolithiation of β-Alkylated Styrene. Tetrahedron Letters. 1997-10-27, s. 7523–7526. ISSN 0040-4039. DOI 10.1016/S0040-4039(97)10022-3.
- ↑ Stephanie Norsikian; Ilan Marek; Sophie Klein; Jean F. Poisson; Jean F. Normant. Enantioselective Carbometalation of Cinnamyl Derivatives: New Access to Chiral Disubstituted Cyclopropanes— Configurational Stability of Benzylic Organozinc Halides. Chemistry – A European Journal. 1999, s. 2055–2068. ISSN 1521-3765. DOI 10.1002/(SICI)1521-3765(19990702)5:7<2055::AID-CHEM2055>3.0.CO;2-9.
- ↑ Michael Tait, Morgan Donnard, Alberto Minassi, Julien Lefranc, Beatrice Bechi, Giorgio Carbone, Peter O'Brien, Jonathan Clayden. Amines Bearing Tertiary Substituents by Tandem Enantioselective Carbolithiation-Rearrangement of Vinylureas. Organic Letters. 2013, s. 34–37. ISSN 1523-7060. DOI 10.1021/ol3029324.
- ↑ Neola F. McKinley; Donal F. O'Shea. Carbolithiation of Diphenylacetylene as a Stereoselective Route to (Z)-Tamoxifen and Related Tetrasubstituted Olefins. The Journal of Organic Chemistry. 2006, s. 9552–9555. DOI 10.1021/jo061949s. PMID 17137396.
- ↑ a b c d Hideki Yorimitsu; Kei Murakami. Recent advances in transition-metal-catalyzed intermolecular carbomagnesiation and carbozincation. Beilstein Journal of Organic Chemistry. 2013-02-11, s. 278–302. ISSN 1860-5397. DOI 10.3762/bjoc.9.34. PMID 23503106.
- ↑ a b Eiji Shirakawa; Takafumi Yamagami; Takahiro Kimura; Shigeru Yamaguchi; Tamio Hayashi. Arylmagnesiation of Alkynes Catalyzed Cooperatively by Iron and Copper Complexes. Journal of the American Chemical Society. 2005, s. 17 164 – 17 165. DOI 10.1021/ja0542136. PMID 16332046.
- ↑ Eiichi Negishi; Joseph A. Miller. Selective carbon-carbon bond formation via transition metal catalysis. 37. Controlled carbometalation. 16. Novel syntheses of .alpha.,.beta.-unsaturated cyclopentenones via allylzincation of alkynes. Journal of the American Chemical Society. 1983-10-01, s. 6761–6763. ISSN 0002-7863. DOI 10.1021/ja00360a060.
- ↑ Fei Xue; Jin Zhao; T. S. Andy Hor; Tamio Hayashi. Nickel-Catalyzed Three-Component Domino Reactions of Aryl Grignard Reagents, Alkynes, and Aryl Halides Producing Tetrasubstituted Alkenes. Journal of the American Chemical Society. 2015-03-11, s. 3189–3192. ISSN 0002-7863. DOI 10.1021/ja513166w. PMID 25714497.
- ↑ Kei Murakami; Hideki Yorimitsu; Koichiro Oshima. Cobalt-Catalyzed Benzylzincation of Alkynes. Chemistry – A European Journal. 2010, s. 7688–7691. ISSN 1521-3765. DOI 10.1002/chem.201001061. PMID 20521290.
- ↑ Ei-ichi Negishi; Christophe Copéret; Shengming Ma; Show-Yee Liou; Fang Liu. Cyclic Carbopalladation. A Versatile Synthetic Methodology for the Construction of Cyclic Organic Compounds. Chemical Reviews. 1996, s. 365–394. ISSN 0009-2665. DOI 10.1021/cr950020x. PMID 11848757.
- ↑ Matthew S. Sigman; Katrina H. Jensen. Mechanistic approaches to palladium-catalyzed alkene difunctionalization reactions. Organic & Biomolecular Chemistry. 2008-10-30, s. 4083–4088. ISSN 1477-0539. DOI 10.1039/B813246A. PMID 18972034.
- ↑ Keary M. Engle, Indrawan McAlpine, Rohan P. Marsters, Fen Wang, Mingying He, Shouliang Yang, Gary M. Gallego, Kin S. Yang, David E. Hill. Palladium(II)-catalyzed γ-selective hydroarylation of alkenyl carbonyl compounds with arylboronic acids. Chemical Science. 2018-11-14, s. 8363–8368. ISSN 2041-6539. DOI 10.1039/C8SC03081B. PMID 30542583.
- ↑ Miriam L. O’Duill, Rei Matsuura, Yanyan Wang, Joshua L. Turnbull, John A. Gurak, De-Wei Gao, Gang Lu, Peng Liu, Keary M. Engle. Tridentate Directing Groups Stabilize 6-Membered Palladacycles in Catalytic Alkene Hydrofunctionalization. Journal of the American Chemical Society. 2017-11-08, s. 15 576 – 15 579. ISSN 0002-7863. DOI 10.1021/jacs.7b08383. PMID 28972751.