Acetanhydrid
Acetanhydrid (též anhydrid kyseliny octové, systematicky anhydrid kyseliny ethanové) je organická sloučenina se vzorcem (CH3CO)2O, známá také pod zkratkou Ac2O. jedná se o nejjednodušší izolovatelný anhydrid karboxylové kyseliny, s širokým využitím v organických syntézách. Je to čirá kapalina vyznačující se silným zápachem po kyselině octové, kterou tvoří při reakci se vzdušnou vlhkostí.
| Acetanhydrid | |
|---|---|
 Vzhled | |
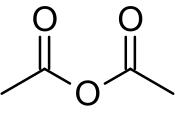
 Struktura | |
| Obecné | |
| Systematický název | Anhydrid kyseliny octové |
| Ostatní názvy | Acetanhydrid |
| Sumární vzorec | C4H6O3 |
| Vzhled | Průhledná kapalina |
| Identifikace | |
| Registrační číslo CAS | 108-24-7 |
| Vlastnosti | |
| Molární hmotnost | 102,09 g/mol |
| Teplota tání | −73,1 °C (200,0 K) |
| Teplota varu | 139,8 °C (413 K) |
| Hustota | 1,082 g/cm3 |
| Index lomu | 1,390 1 |
| Rozpustnost ve vodě | 2,6 g/100 ml |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R10 R20/22 R34 |
| S-věty | (S1/2) S26 S36/37/39 S45 |
| NFPA 704 |  2
2
1
|
| Teplota vzplanutí | 49 °C |
| Teplota vznícení | 316 °C |
| Meze výbušnosti | 2,7–10,3 % |
Některá data mohou pocházet z datové položky. | |
Struktura a vlastnosti
editovatAcetanhydrid je flexibilní molekulou, jejíž struktura není planární.[2] Rezonanční posun elektronů pí vazeb přes centrální atom kyslíku má jen malý vliv na stabilitu struktury oproti dipólové interakci mezi dvěma karbonylovými kyslíky. Rozdíly v energiích mezi nejvýhodnějšími možnostmi prostorového uspořádání jsou rovněž nízké.[3]
Jako u většiny anhydridů i zde platí, že karbonylový atom uhlíku má elektrofilní charakter a odstupující skupinou je karboxylát. Na vysokou elektrofilitu má vliv asymetrická prostorová struktura.
Výroba
editovatAcetanhydrid poprvé syntetizoval v roce 1852 francouzský chemik Charles Frédéric Gerhardt zahříváním octanu draselného s benzoylchloridem.[4] Nukleofilní acylová substituce chloridu kyseliny karboxylátovým aniontem je typický způsob přípravy anhydridů obecně.[5]
Průmyslově se vyrábí reakcí oxidu uhelnatého s methylesterem kyseliny octové,[6] dle rovnice:
Tato reakce probíhá za katalýzy jodidem lithným a jodidem rhoditým.
Lze jej rovněž vyrobit reakcí ketenu s kyselinou octovou při teplotě 45–55 °C a nízkém tlaku (0,05–0,2 bar). Tento způsob byl vyvinut v roce 1922 firmou Wacker Chemie v reakci na rostoucí poptávku acetanhydridu pro výrobu acetátu celulózy.[7]
Díky nízké ceně není acetanhydrid běžně v laboratořích připravován.
Reakce
editovatAcetanhydrid je vhodným činidlem pro acetylaci, tedy navázání acetylové skupiny na organické substráty. V těchto reakcích figuruje jako zdroj CH3CO+.
Acetylace alkoholů a aminů
editovatAlkoholy lze acetylovat snadno,[8] reakce probíhá dle obecné rovnice
za vzniku esterů kyseliny octové a kyseliny octové. Katalyzátorem je často báze, např. pyridin, pro specializované aplikace se využívají skandiové soli jakožto Lewisovy kyseliny.[9] Obdobná je reakce s aminy.
Acetylace aromatických kruhů
editovatAcetanhydrid rovněž acetyluje aromatická jádra, obvykle za katalýzy kyselinami. Mezi názorné reakce patří acetylace benzenu na acetofenon[10] a ferrocenu na acetylferrocen:[11]
- (C5H5)2Fe + (CH3CO)2O → (C5H5)Fe(C5H4COCH3) + CH3CO2H
Příprava dalších anhydridů
editovatDikarboxylové kyseliny tvoří po reakci s acetanhydridem příslušné anhydridy.[12] Lze tak připravit i směsné anhydridy, např. acetyl-nitrát reakcí s kyselinou dusičnou.
Hydrolýza
editovatAcetanhydrid se pouze omezeně rozpouští ve vodě, protože s ní reaguje, a lze tedy dosáhnout maximální koncentrace přibližně 2,6 gramů ve 100 mililitrech vody;[13] stabilita vodných roztoku je omezená, protože sloučenina reaguje na produkt volně mísitelný s vodou:[14]
Aby se předešlo znehodnocení acetanhydridu vzdušnou vlhkostí, je nutné jej skladovat ve vzduchotěsných ampulích a po otevření se musí rychle spotřebovat.
Využití
editovatAcetanhydrid se využívá zejména na acetylaci průmyslově významných chemických surovin. Nejrozšířenějším použitím je převádění celulózy na acetát celulózy, který je součástí fotografického filmu, jiných potažených materiálů a cigaretových filtrů. Acetylací kyseliny salicylové vzniká kyselina kyselina acetylsalicylová, známá pod obchodními názvy aspirin či acylpyrin. V autoklávu lze acetanhydrid využít k napuštění a následné acetylaci dřeva za účelem zvýšení jeho odolnosti.[15] V potravinářství je běžným acetylačním činidlem při výrobě modifikovaných škrobů (E1414, E1420, E1422).
Rovněž se používá při výrobě heroinu (diacetylmorfinu) z morfia.
Právní postavení
editovatAcetanhydrid lze využít k acetylaci morfinu na heroin (diacetylmorfin). Z tohoto důvodu je na seznamu regulovaných látek americké DEA, a v mnoha dalších zemích je jeho prodej omezen.[16][17]
Bezpečnost
editovatAcetanhydrid je dráždivou a hořlavou kapalinou, způsobuje závažné poleptání kůže a má slzotvorné účinky. Škodlivé jsou i páry.[18] Kvůli reaktivitě s vodou a alkoholem jsou pro hašení požáru preferované pěnové nebo sněhové hasicí přístroje.[19]
Reference
editovatV tomto článku byl použit překlad textu z článku Acetic anhydride na anglické Wikipedii.
- ↑ a b Acetic anhydride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ SEIDEL, R. W.; GODDARD, R.; NÖTHLING, N. Acetic anhydride at 100 K: the first crystal structure determination. Acta Crystallographica Section C: Structural Chemistry. 2016-10-01, roč. 72, čís. 10, s. 753–757. Dostupné online [cit. 2023-10-28]. ISSN 2053-2296. DOI 10.1107/S2053229616015047. (anglicky)
- ↑ WU, Guang; VAN ALSENOY, C.; GEISE, H. J. Acetic Anhydride in the Gas Phase, Studied by Electron Diffraction and Infrared Spectroscopy, Supplemented With ab Initio Calculations of Geometries and Force Fields. The Journal of Physical Chemistry A. 2000-02-01, roč. 104, čís. 7, s. 1576–1587. Dostupné online [cit. 2023-10-28]. ISSN 1089-5639. DOI 10.1021/jp993131z. (anglicky)
- ↑ GERHARDT, Charles. Recherches sur les acides organiques anhydres. [s.l.]: [s.n.] 1074 s. Dostupné online. (francouzsky) Google-Books-ID: MXkbAAAAMAAJ.
- ↑ MCMURRY, John. Organic chemistry. Ninth edition. vyd. Boston, MA, USA: Cengage Learning 1054 s. ISBN 978-1-305-08048-5, ISBN 978-1-305-63871-6. S. 701.
- ↑ ZOELLER, Joseph R.; AGREDA, Victor H.; COOK, Steven L. Eastman chemical company acetic anhydride process. Catalysis Today. 1992-03-11, roč. 13, čís. 1, s. 73–91. Dostupné online [cit. 2023-10-27]. ISSN 0920-5861. DOI 10.1016/0920-5861(92)80188-S.
- ↑ History. www.wacker.com [online]. [cit. 2023-10-27]. Dostupné online. (anglicky)
- ↑ Chemical of the Week -- Acetic Acid and Acetic Anhydride. web.archive.org [online]. 2006-03-03 [cit. 2023-10-27]. Dostupné v archivu pořízeném z originálu dne 2006-03-03.
- ↑ Organic Syntheses Procedure. www.orgsyn.org [online]. [cit. 2023-10-27]. Dostupné online. (anglicky)
- ↑ Organic Syntheses Procedure. orgsyn.org [online]. [cit. 2023-10-27]. Dostupné online. (anglicky)
- ↑ TABER, Douglas F. Column chromatography: Preparation of Acetyl Ferrocene. valhalla.chem.udel.edu [online]. Department of Chemistry and Biochemistry, University of Delaware [cit. 2023-10-27]. Dostupné v archivu pořízeném z originálu dne 2009-05-02.
- ↑ Organic Syntheses Procedure. orgsyn.org [online]. [cit. 2023-10-27]. Dostupné online. (anglicky)
- ↑ Acetic Anhydride: Frequently Asked Questions. www.bp.com [online]. British Petroleum [cit. 2023-10-27]. Dostupné v archivu pořízeném z originálu dne 2007-10-11.
- ↑ Acetic Anhydride: Material Safety Data Sheet (PDF). www.celanese.com [online]. Celanese [cit. 2023-10-27]. Dostupné v archivu pořízeném z originálu dne 2007-09-27.
- ↑ Making Wood Last Forever With Acetylation. Chemical & Engineering News [online]. [cit. 2023-10-27]. Dostupné online. (anglicky)
- ↑ Federal Register :: Request Access. unblock.federalregister.gov [online]. [cit. 2023-10-27]. Dostupné online.
- ↑ UN Intercepts Taliban's Heroin Chemical in Rare Afghan Victory - Bloomberg. web.archive.org [online]. 2012-10-22 [cit. 2023-10-27]. Dostupné v archivu pořízeném z originálu dne 2012-10-22.
- ↑ ICSC 0209 - ACETIC ANHYDRIDE. www.inchem.org [online]. [cit. 2023-10-27]. Dostupné online.
- ↑ CDC - NIOSH Pocket Guide to Chemical Hazards - Acetic anhydride. www.cdc.gov [online]. [cit. 2023-10-27]. Dostupné online.
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Acetanhydrid na Wikimedia Commons


