Dessův–Martinův perjodinan
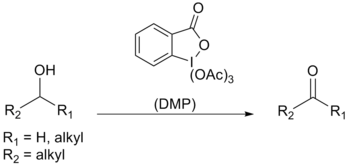
Dessův–Martinův perjodinan (zkráceně DMP) je organická sloučenina používaná při Dessových–Martinových oxidacích, oxidacích primárních alkoholů na aldehydy a sekundárních na ketony.[2][3]
| Dessův–Martinův perjodinan | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 3-oxo-1λ5,2-benziodoxol-1,1,1(3H)-triyltriacetát |
| Sumární vzorec | C13H13IO8 |
| Vzhled | bílá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 87413-09-0 |
| PubChem | 15337 |
| SMILES | CC(=O)OI1(C2=CC=CC=C2C(=O)O1)(OC(=O)C)OC(=O)C |
| InChI | InChI=1S/C13H13IO8/c1-8(15)19-14(20-9(2)16,21-10(3)17)12-7-5-4-6-11(12)13(18)22-14/h4-7H,1-3H3 |
| Vlastnosti | |
| Molární hmotnost | 424,14 g/mol |
| Hustota | 1,362 g/cm3 |
| Bezpečnost | |
| [1] | |
| H-věty | H272 H302 H312 H315 H319 H332 H335[1] |
| P-věty | P210 P220 P261 P264 P270 P271 P302+352 P304+340 P305+351+338 P321 P330 P370+378 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Tato látka má několik výhod oproti dimethylsulfoxidu a oxidačních činidlech založených na chromu, jako jsou mírnější podmínky reakcí (pokojová teplota, neutrální pH), kratší časy reakcí, vyšší výtěžnosti, jednodušší postup, vysoká chemoselektivita, využitelnost i citlivých funkčních skupin a dlouhá životnost. Jejímu využití v průmyslu ovšem brání vysoká cena a potenciální výbušnost.[4]
DMP objevili v roce 1983 američtí chemici Daniel Benjamin Dess a James Cullen Martin. Odvozena je od kyseliny 2-jodoxybenzoové (IBX), na níž jsou navázány tři acetátové skupiny, jež navyšují reaktivitu a zlepšují rozpustnost sloučeniny v organických rozpouštědlech.[5]
Příprava
editovatNejprve se připraví IBX reakcí kyseliny 2-jodbenzoové s vodným roztokem hydrogenperoxosíranu draselného za zvýšené teploty po dobu 3 hodin.[6] Poté se IBX acyluje.[7]
Navázání acetylových skupin vede k vyšším výtěžkům a zjednodušuje provedení reakcí. Pevné produkty se získají filtrací a promytím diethyletherem. R. E. Ireland a L. Liu použili katalytické množství kyseliny p-toluensulfonové, čímž dosáhli dokončení reakce za méně než 2 hodiny (původní syntéza trvala 24 hodin), s výtěžnostmi nad 90 %.
Jiný postup představili R. K. Boeckman a J. J. Mullins,[8] šlo o zahřívání roztoku bromičnanu draselného, kyseliny sírové a kyseliny 2-jodbenzoové za vzniku kyseliny 2-jodoxybenzoové, která byla následně acylovaná kyselinou octovou a acetanhydridem.
Mechanismus oxidace
editovatDessův–Martinův perjodinan se používá hlavně jako oxidační činidlo pro alkoholy se složitou strukturou, obsahující více různých substituentů nebo citlivé skupiny. Jedním z důvodů jeho vysoké účinnosti je selektivní komplexace s hydroxylovými skupinami, která u alkoholů umožňuje rychlou výměnu ligandů, což je první krok oxidace.
Protonovou NMR bylo zjištěno, že jeden ekvivalent alkoholu vytvoří diacetoxyalkoxyperjodinanový meziprodukt. Následně octanový anion, sloužící jako zásada, deprotonuje α-vodík alkoholu za vzniku karbonylové sloučeniny, jodinanu a kyseliny octové.
Při použití diolu nebo více ekvivalentů jednosytného alkoholu vznikne acetoxydialkoxyperjodinan. V důsledku nestálosti tohoto perjodinanu je oxidace mnohem rychlejší.[5]
S. L. Schreiber se svými spolupracovníky zjistil, že rychlost oxidace je vyšší za přítomnosti vody.[9] Dess a Martin již předtím objevili, že se oxidace ethanolu urychlí přidáním dalšího ekvivalentu ethanolu. Předpokládá se, že navýšení míry disociace acetátového ligandu od jodu se zvyšuje z důvodu dodávání elektronů na hydroxyl, což oslabuje vazbu I-OAc.[5]
Chemoselektivita
editovatZa podmínek standardních pro reakce Dessova–Martinova perjodinanu lze oxidovat alkoholy na aldehydy či ketony, aniž by byly ovlivněny furanové kruhy, thioethery, enolethery a sekundární amidy.[5] DMP snadno oxiduje allylalkoholy, které se běžnými oxidačními činidly na karbonylové sloučeniny převádějí obtížně.[10]
A. G. Myers přišel na to, že DMP může oxidovat aminoalkoholy chráněné na atomech dusíku, a to bez epimerizace (ke které dochází s většinou jiných oxidantů, například při Swernově oxidaci). Tyto chráněné aminoalkoholy mají význam ve farmaceutickém průmyslu.[11]
Benzyl- a allylalkoholy reagují rychleji než nasycené alkoholy,[5] zatímco aldoximy a ketoximy se na odpovídající aldehydy a ketony oxidují rychleji než primární, sekundární a benzylové alkoholy.[12]
Jako příklad Dessovy–Martinovy oxidace mohou sloužit přeměny citlivých α-β-nenasycených alkoholů na příslušné aldehydy. Takovéto skupiny se nacházejí v několika přírodních látkách a jsou užitečnými stavebními prvky v organické syntéze. C. Thongsornkleeb a Rick L. Danheiser zoxidovali takovýto alkohol pomocí Dessova–Martinova perjodinanu a pozměněným postupem (ředění pentanem a promytí poly(4-vinylpyridinem)) odstranili v průběhu reakce vytvořwnou kyselinu octovou; produkt byl pak zfiltrován a zkoncentrován destilací.[13]
t-Butyl DMP
editovatDifluor- a monofluoralkoholy se oxidují obtížněji. Lze u nich použít Swernovu oxidaci, kdy je ale nutný velký přebytek oxidačního činidla a v některých případech výsledky nejsou reprodukovatelné. Ve většině těchto případů může být použit DMP,[14] což ovšem neplatí u alkoholů obsahujících nukleofilní funkční skupiny, které z DMP odštěpují acetátové skupiny. S níže znázorněnou sloučeninou je možné získat takové karbonyly navázáním terc-butoxy skupin na DMP, jež vytvoří sterické efekty, skrz které se tyto vedlejší reakce omezí.
Odkazy
editovatSouvisející články
editovat- Oxidace alkoholů
- Chlorchroman pyridinia
- Jonesova oxidace
- Oppenauerova oxidace
- Pfitznerova–Moffattova oxidace
- Parikhova–Doeringova oxidace
- Albrightova–Goldmanova oxidace
- Swernova oxidace
- Coreyova–Kimova oxidace
- Ruthenistan tetrapropylamonný
- TEMPO
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Dessův–Martinův perjodinan na Wikimedia Commons
Reference
editovatV tomto článku byl použit překlad textu z článku Dess–Martin periodinane na anglické Wikipedii.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/159087
- ↑ D. B. Dess; J. C. Martin. Readily accessible 12-I-5 oxidant for the conversion of primary and secondary alcohols to aldehydes and ketones. The Journal of Organic Chemistry. 1983, s. 4155–4156. DOI 10.1021/jo00170a070.
- ↑ Robert J. Boeckman; Kelly M. George. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2009. ISBN 978-0471936237. DOI 10.1002/047084289X.rt157m.pub2. Kapitola 1,1,1-Triacetoxy-1,1-dihydro-1,2-benziodoxol-3(1H)-one.
- ↑ J. B. Plumb; D. J. Harper. Chemical Safety: 2-Iodoxybenzoic acid. Chemical & Engineering News. 1990, s. 3. DOI 10.1021/cen-v068n029.p002.
- ↑ a b c d e D. B. Dess; J. C. Martin. A useful 12-I-5 triacetoxyperiodinane (the Dess-Martin periodinane) for the selective oxidation of primary or secondary alcohols and a variety of related 12-I-5 species. Journal of the American Chemical Society. 1991, s. 7277–7287. DOI 10.1021/ja00019a027.
- ↑ M. Frigerio; M. Santagostino; S. Sputore. A User-Friendly Entry to 2-Iodoxybenzoic Acid (IBX). The Journal of Organic Chemistry. 1999, s. 4537–4538. DOI 10.1021/jo9824596.
- ↑ R. E. Ireland; L. Liu. An improved procedure for the preparation of the Dess-Martin periodinane. The Journal of Organic Chemistry. 1993, s. 2899. DOI 10.1021/jo00062a040.
- ↑ BOECKMAN JR., R. K.; SHAO, P.; MULLINS, J. J. The Dess-Martin Periodinane | 1,1,1-Triacetoxy-1,1-dihydro-1,2-benziodoxol-3(1H)-one. Org. Synth.. 2004. Dostupné online.; Coll. Vol.. S. 696.
- ↑ S. D. Meyer; S. L. Schreiber. Acceleration of the Dess-Martin Oxidation by Water. The Journal of Organic Chemistry. 1994, s. 7549–7552. DOI 10.1021/jo00103a067.
- ↑ N. J. Lawrence; J. P. Crump; A. T. McGown; J. A. Hadfield. Reaction of Baylis-Hillman products with Swern and Dess-Martin oxidants. Tetrahedron Letters. 2001, s. 3939–3941. DOI 10.1016/S0040-4039(01)00587-1.
- ↑ A. G. Myers et al. Synthesis of highly epimerizable N-protected amino aldehydes of high enantiomeric excess. Tetrahedron Letters. 2000, s. 1359. DOI 10.1016/S0040-4039(99)02293-5.
- ↑ S. S. Chaudhari; K. G. Akamanchi. A mild, chemoselective, oxidative method for deoximation using Dess-Martin periodinane. Synthesis. 1999, s. 760–764. DOI 10.1055/s-1999-3476.
- ↑ C. Thongsornkleeb; R. L. Danheiser. A Practical Method for the Synthesis of 2-Alkynylpropenals. The Journal of Organic Chemistry. 2005, s. 2364–2367. DOI 10.1021/jo047869a. PMID 15760233.
- ↑ R. J. Linderman; D. M. Graves. Oxidation of Fluoroalkyl-Substituted Carbinols by the Dess-Martin reagent. The Journal of Organic Chemistry. 1989, s. 661–668. DOI 10.1021/jo00264a029.