Hexakarbonyl molybdenu
Hexakarbonyl molybdenu je chemická sloučenina se vzorcem Mo(CO)6. Jedná se, podobně jako u hexakabonylů chromu a wolframu, o těkavou, na vzduchu stálou, pevnou látku obsahující kov v oxidačním čísle 0.
| Hexakarbonyl molybdenu | |
|---|---|
 Strukturní vzorec | |
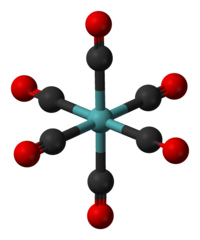 Model molekuly | |
| Obecné | |
| Systematický název | hexakarbonyl molybdenu |
| Funkční vzorec | Mo(CO)6 |
| Sumární vzorec | MoC6O6 |
| Vzhled | růžové krystaly |
| Identifikace | |
| Registrační číslo CAS | 13939-06-5 |
| EC-no (EINECS/ELINCS/NLP) | 237-713-3 |
| PubChem | 98885 |
| ChEBI | 30508 |
| SMILES | O=C=[Mo](=C=O)(=C=O)(=C=O)(=C=O)=C=O |
| InChI | InChI=1S/6CO.Mo/c6*1-2; |
| Vlastnosti | |
| Molární hmotnost | 264,02 g/mol |
| Teplota tání | 150 °C (423 K) |
| Teplota varu | 156 °C (429 K) |
| Hustota | 1,96 g/cm3 |
| Rozpustnost ve vodě | nerozpustný |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu a diethyletheru |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −989,1 kJ/mol |
| Standardní molární spalná entalpie ΔH°sp | −2123,4 kJ/mol |
| Bezpečnost | |
| H-věty | H300 H310 H315 H319 H330 H413 |
| P-věty | P261 P271 P280 P304+340+311 P405 P501 |
Některá data mohou pocházet z datové položky. | |
Struktura a vlastnosti
editovatMo(CO)6 má oktaedrickou geometrii vytvořenou šesti CO ligandy navázanými na atom Mo.
Mo(CO)6 se připravuje redukcí chloridů nebo oxidů molybdenu oxidem uhelnatým, díky jeho nízké ceně ale není nutná příprava v laboratoři.[1] Na vzduchu je stálý a v nepolárních organických rozpouštědlech jen málo rozpustný.
Výskyt
editovatMo(CO)6 byl nalezen na skládkách a v odpadních vodách, kde se vyskytují redukční anaerobní podmínky, napomáhající jeho tvorbě.[2]
Využití ve výzkumu
editovatHexakarbonyl molybdenu je často používán ve výzkumu.[3] Jeden nebo více CO ligandů lze nahradit jinými a vytvořit tak další komplexy.[4] Mo(CO)6, [Mo(CO)3(MeCN)3] a obdobné sloučeniny se používají jako katalyzátory v organické syntéze, například při metatezích alkynů a Pausonových–Khandových reakcích.
Mo(CO)6 reaguje s 2,2′-bipyridinem za vzniku Mo(CO)4(bipy). Ultrafialovou fotolýzou roztoku Mo(CO)6 v tetrahydrofuranu vzniká Mo(CO)5(THF).
[Mo(CO)4(piperidin)2]
editovatTepelnou reakcí Mo(CO)6 s piperidinem vzniká komplex Mo(CO)4(piperidin)2. Piperidinové ligandy jsou zde nestálé, což umožňuje navázání jiných ligandů za mírných podmínek; například reakcí s trifenylfosfinem ve vroucím dichlormethanu (teplota varu kolem 40 °C) se vytváří cis-[Mo(CO)4(PPh3)2]. Tento cis- komplex se v toluenu izomerizuje na trans-[Mo(CO)4(PPh3)2].[5]
[Mo(CO)3(MeCN)3]
editovatMo(CO)6 lze také přeměnit na tris(acetonitril)ový komplex; ten se dá použít jako zdroj Mo(CO)3, kde například reakcí s allylchloridem vzniká [MoCl(allyl)(CO)2(MeCN)2], zatímco za přítomnosti KTp se tvoří anion [MoTp(CO)3]− a reakcí s cyklopentadienidem sodným [MoCp(CO)3]−. Tyto anionty reagují s řadou různých elektrofilů.[6] Podobným zdrojem Mo(CO)3 je trikarbonyl cykloheptatrienmolybdenu.
Zdroj atomů Mo
editovatHexakarbonyl molybdenu se používá při depozici indukované paprskem elektronů, protože se snadno odpařuje a následně paprskem elektronů rozkládá za uvolnění atomů molybdenu.[7]
Bezpečnost
editovatStejně jako ostatní karbonyly kovů je Mo(CO)6 nebezpečný jakožto těkavý zdroj kovu a oxidu uhelnatého.
Odkazy
editovatReference
editovatV tomto článku byl použit překlad textu z článku Molybdenum hexacarbonyl na anglické Wikipedii.
- ↑ GREENWOOD, N. N.; EARNSHAW, A. Chemie prvků. 1. vyd. Praha: Informatorium, 1993. 1635 s. ISBN 80-85427-38-9. S. 1281–1283.
- ↑ J. Feldmann. Determination of Ni(CO)4, Fe(CO)5, Mo(CO)6, and W(CO)6 in Sewage Gas by Using Cryotrapping Gas Chromatography Inductively Coupled Plasma Mass Spectrometry. Journal of Environmental Monitoring. 1999, s. 33–37. DOI 10.1039/a807277i. PMID 11529076.
- ↑ J. W. Faller; K. M. Brummond; B. Mitasev. Encyclopedia of Reagents for Organic Synthesis. New York: John Wiley & Sons, 2006. ISBN 0471936235. DOI 10.1002/047084289X.rh004.pub2. Kapitola Hexacarbonylmolybdenum.
- ↑ THE SYNTHESIS & SPECTROSCOPIC CHARACTERISATION OF METAL CARBONYL COMPLEXES [online]. Dostupné v archivu pořízeném z originálu dne 2008-03-09.
- ↑ D. J. Darensbourg; R. L. Kump. A Convenient Synthesis of cis-Mo(CO)4L2 Derivatives (L = Group 5a Ligand) and a Qualitative Study of Their Thermal Reactivity toward Ligand Dissociation. Inorganic Chemistry. 1978. DOI 10.1021/ic50187a062.
- ↑ C. Elschenbroich; A. Salzer. Organometallics: A Concise Introduction. [s.l.]: Wiley-VCH, 1992. ISBN 3-527-28165-7.
- ↑ S. J. Randolph; J. D. Fowlkes; P. D. Rack. Focused, Nanoscale Electron-Beam-Induced Deposition and Etching. Critical Reviews of Solid State and Materials Sciences. 2006, s. 55–89. DOI 10.1080/10408430600930438. Bibcode 2006CRSSM..31...55R.
Literatura
editovat- MARRADI, M. Synlett Spotlight 119: Molybdenum Hexacarbonyl [Mo(CO)6]. Synlett. 2005, s. 1195–1196. Dostupné online. DOI 10.1055/s-2005-865206.
- FELDMANN, J.; CULLEN, W. R. Occurrence of Volatile Transition Metal Compounds in Landfill Gas: Synthesis of Molybdenum and Tungsten Carbonyls in the Environment. Environ. Sci. Technol.. 1997, s. 2125–2129. DOI 10.1021/es960952y. Bibcode 1997EnST...31.2125F.
- FELDMANN, J.; GRÜMPING, R.; HIRNER, A. V. Determination of Volatile Metal and Metalloid Compounds in Gases from Domestic Waste Deposits with GC/ICP-MS. Fresenius' J. Anal. Chem.. 1994, s. 228–234. Dostupné online. DOI 10.1007/BF00322474. S2CID 95405500.
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Hexakarbonyl molybdenu na Wikimedia Commons
