Kyselina krokonová
Kyselina krokonová je organická sloučenina, derivát cyklopentenu s dvěma hydroxylovými skupinami navázanými na dvojnou vazbu a třemi ketonovými skupinami. Látka vytváří žluté krystaly citlivé na světlo,[2] rozpustné ve vodě a ethanolu[3] a rozkládající se za teplot nad 212 °C.[4]
| Kyselina krokonová | |
|---|---|
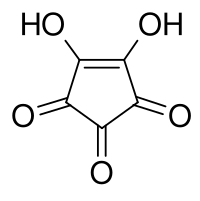 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 4,5-dihydroxycyklopent-4-en-1,2,3-trion |
| Sumární vzorec | C5H2O5 |
| Identifikace | |
| Registrační číslo CAS | 488-86-8 |
| EC-no (EINECS/ELINCS/NLP) | 676-473-8 |
| PubChem | 546874 |
| SMILES | O=C1C(O)=C(O)C(=O)C1=O |
| InChI | InChI=1S/C5H2O5/c6-1-2(7)4(9)5(10)3(1)8/h6-7 |
| Vlastnosti | |
| Molární hmotnost | 142,07 g/mol |
| Teplota rozkladu | > 300 °C (573 K) |
| Rozpustnost ve vodě | rozpustná |
| Rozpustnost v polárních rozpouštědlech | rozpustná v ethanolu |
| Bezpečnost | |
| [1] | |
| H-věty | H315 H319 H335[1] |
| P-věty | P261 P264+265 P271 P280 P302+352 P304+340 P305+351+338 P319 P321 P332+317 P337+317 P362+364 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Molekula je kyselá, snadno odštěpuje protony z hydroxylových skupin (pKa1 = 0,80±0,08 a pKa2 = 2,24±0,01 25 °C),[5][6] vzniklé anionty, hydrogenkrokonát (C5HO -
5 [2] a krokonát (C5O 2-
5 ) jsou poměrně stálé. Krokonátový ion je aromatický[7] a, v důsledku delokalizace dvojné vazby a záporného náboje přes pět CO jednotek, také symetrický (protože obsahuje dva π elektrony, tak je podle Hückelova pravidla aromatický). Lithná, sodná a draselná sůl kyseliny krokonové krystalizují z vodných roztoků jako dihydráty,[8] draselnou lze přeměnit na (oranžově zbarvený) monohydrát.[2][5] amonná, rubidná a cesná sůl krystalizují jako bezvodé.[8] Popsány jsou také krokonát barnatý, olovnatý a stříbrný.[2]
Kyselina krokonová vytváří také estery, například dimethylkrokonát.
Struktura
editovatStruktura pevné kyseliny krokonové obsahuje skládané pruhy, jejichž „strany“ tvoří rovinné kruhy obsahující 4 molekuly C5O5H2 propojené vodíkovými vazbami.[8] V dioxanu má velký dipólový moment 9–10 D, u volné molekuly se dipólový moment odhaduje na 7–7,5 D.[9] Pevná forma je feroelektrická, s Curieovou teplotou přesahující 150 °C,[10] a má ze všech organických krystalických látek nejvyšší spontánní polarizaci (kolem 20 μC/cm2), způsobenou přenosy protonů mezi sousedními molekulami v pruzích.[9]
V pevných solích s alkalickými kovy vytváří krokonátové anionty a kationty kovů rovnoběžné sloupce.[8] U smíšené soli K3(HC5O5)(C5O5)·2H2O, obsahující krokonátový dianion (C5O 2-
5 ) a hydrogenkrokonátový monoanion (HC5O -
5 ) je vodík rovnoměrně sdílen oběma sousedními krokonátovými jednotkami.[8]
Soli krokonátového aniontu a jejich deriváty se studují v supramolekulární chemii.[11]
Infračervenou a Ramanovou spektroskopií bylo zjištěno vyrovnávání délek vazeb uhlík–uhlík, potvrzující delokalizaci elektronů, doprovázené zvyšováním velikosti protiiontů v solích.[7] Výpočty na základě teorie funkcionálu hustoty byly v souladu s těmito zjištěními.
Krokonátový anion tvoří s přechodnými kovy dvouvazné komplexní hydráty s obecným vzorcem MC5O5·3H2O, kde může být měď (pak vzniká hnědá pevná látka), železo (taková sůl je tmavě fialová), zinek (žlutý), nikl (zelený), mangan (tmavě zelený), nebo kobalt (fialový). Všechny tyto komplexy jsou ortorombické a obsahují řetězce, kde se střídají krokonátové anionty s kationty kovů. Každý krokonátový ion je jedním atomem kyslíku navázán na předchozí atom kovu a dvojicí kyslíku na další kov, dva kyslíky se tak vazeb neúčastní. Atomy kovů mají na sebe navázány vždy tři krokonátové kyslíky a jednu molekulu vody.[12] Sloučeninu s podobným vzorcem (žlutě zbarvenou) vytváří také vápník, struktura této soli je ale jiná.[12]
Krokonátový anion vytváří i soli s trojvaznými kationty, například hlinitými (žlutá), chromitými (hnědá) a železitými (fialová). Tyto sloučeniny také obsahují hydroxylové skupiny i krystalovou vodu a mají složitější krystalové struktury.[12] Nebyly nalezeny žídné známky sendvičových vazeb mezi kovy a delokalizovanými elektrony, jaké se vyskytují například u ferrocenu,[12] anion ale může s kovy tvořit komplexy vázané mnoha různými způsoby, které mohou k vazbám využívat jediný, ale i všech pět kyslíkových atomů.[13][14][15]
Odkazy
editovatReference
editovatV tomto článku byl použit překlad textu z článku Croconic acid na anglické Wikipedii.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/546874
- ↑ a b c d K. Yamada; N. Mizuno; Y. Hirata. Structure of croconic acid. Bulletin of the Chemical Society of Japan. 1958, s. 543–549. DOI 10.1246/bcsj.31.543.
- ↑ W. A. Miller. Elements of Chemistry: Theoretical and Practical. [s.l.]: Longmans, 1868.
- ↑ Edward Turner. Elements of Chemistry. [s.l.]: [s.n.], 1837. Dostupné online.
- ↑ a b L. M. Schwartz; R. I. Gelb; J. O. Yardley. Aqueous dissociation of croconic acid. Journal of Physical Chemistry. 1975, s. 2246–2251. DOI 10.1021/j100588a009.
- ↑ R. I. Gelb; L. M. Schwartz; D. A. Laufer; J. O. Yardley. The structure of aqueous croconic acid. Journal of Physical Chemistry. 1977, s. 1268–1274. DOI 10.1021/j100528a010.
- ↑ a b S. L. Georgopoulos; R. Diniz; M. I. Yoshida; N. L. Speziali; H. F. Dos Santos; G. M. A. Junqueira; L. F. C. de Oliveira. Vibrational spectroscopy and aromaticity investigation of squarate salts: A theoretical and experimental approach. Journal of Molecular Structure. 2006, s. 63–70. DOI 10.1016/j.molstruc.2006.01.035. Bibcode 2006JMoSt.794...63G.
- ↑ a b c d e D. Braga; L. Maini; F. Grepioni. Croconic acid and alkali metal croconate salts: Some new insights into an old story. Chemistry: A European Journal. 2002, s. 1804–1812. DOI 10.1002/1521-3765(20020415)8:8<1804::AID-CHEM1804>3.0.CO;2-C. PMID 11933108.
- ↑ a b S. Horiuchi, Y. Tokunaga, G. Giovannetti, S. Picozzi, H. Itoh, R. Shimano, R. Kumai, Y. Tokura. Above-room-temperature ferroelectricity in a single-component molecular crystal. Nature. 2010, s. 789–792. DOI 10.1038/nature08731. PMID 20148035. Bibcode 2010Natur.463..789H.
- ↑ Discovery of Ferroelectricity of Croconic Acid, a Low-molecular-weight Organic Compound, at Room Temperature. www.aist.go.jp [online]. 2010-03-10 [cit. 2023-08-05]. Dostupné online.
- ↑ L. F. O. Faria; A. L. Soares; R. Diniz; M. I. Yoshida; H. G. M. Edwards; L. F. C. de Oliveira. Mixed salts containing croconate violet, lanthanide and potassium ions: Crystal structures and spectroscopic characterization of supramolecular compounds. Inorganica Chimica Acta. 2010, s. 49–56. DOI 10.1016/j.ica.2009.09.050.
- ↑ a b c d WEST, R.; NIU, H. Y. New aromatic anions. VI. Complexes of croconate ion with some divalent and trivalent metals (Complexes of divalent transition metal croconates and trivalent metal croconates). Journal of the American Chemical Society. 1963, s. 2586. DOI 10.1021/ja00900a013.
- ↑ J. Carranza; J. Sletten; F. Lloret; M. Julve. Manganese(II) complexes with croconate and 2-(2-pyridyl)imidazole ligands: Syntheses, X-ray structures and magnetic properties. Inorganica Chimica Acta. 2009, s. 2636–2642. DOI 10.1016/j.ica.2008.12.002.
- ↑ A. K. Ghosh; E. Zangrando; N. R. Chaudhuri. 3D supramolecular networks of Co(II)/Fe(II) using the croconate dianion and a bipyridyl spacer: Synthesis, crystal structure and thermal study. Polyhedron. 2007, s. 1105–1112. DOI 10.1016/j.poly.2006.09.100.
- ↑ Chih-Chieh Wang, Meu-Ju Ke, Cheng-Hsiao Tsai, I-Hsuan Chen, Shin-I Lin, Tzuen-Yeuan Lin, Li-Mei Wu, Gene-Hsiang Lee, Hwo-Shuenn Sheu, Vladimir E. Fedorov. [M(C5O5)2(H2O)n]2− as a Building Block for Hetero- and Homo-bimetallic Coordination Polymers: From 1D Chains to 3D Supramolecular Architectures. Crystal Growth & Design. 2009-02-04, s. 1013–1019. Dostupné online. ISSN 1528-7483. DOI 10.1021/cg800827a.
Související články
editovat- Krokonátová violeť
- Krokonátová modř
- Kyselina rhodizonová
- Kyselina kvadrátová
- Kyselina deltová
- Cyklopentanpenton (kyselina leukonová)
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Kyselina krokonová na Wikimedia Commons
