Kyselina deltová
Kyselina deltová (systematicky 2,3-dihydroxycykloprop-2-en-1-on) je organická sloučenina se vzorcem C3O(OH)2; lze ji považovat za keton i dvojitý enol cyklopropenu. Za pokojové teploty jde o stálou bílou pevnou látku, rozpustnou v diethyletheru a pomalu reagující s vodou.[1] Při teplotě 140 °C až 180 °C se (někdy i explozivně) rozkládá.[1]
| Kyselina deltová | |
|---|---|
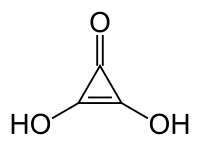 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 2,3-dihydroxycykloprop-2-en-1-on |
| Sumární vzorec | C3H2O3 |
| Identifikace | |
| Registrační číslo CAS | 54826-91-4 |
| PubChem | 11679790 |
| SMILES | O=C1C(O)=C1O |
| InChI | InChI=1/C3H2O3/c4-1-2(5)3(1)6/h4-5H |
| Vlastnosti | |
| Molární hmotnost | 86,046 g/mol |
Některá data mohou pocházet z datové položky. | |
Deriváty
editovatSoli
editovatKyselina deltová je, jako endiol, poměrně silnou kyselinou (pKa1 = 2,57, pKa2 = 6,03), úplnou disociací z ní vzniká deltátový anion, C3O 2-
3 .
První deltátové soli (lithná a draselná) byly popsány v roce 1976. Deltát lithný, Li2C3O3, je bílá pevná látka rozpustná ve vodě.[1]
Podobně jako jiné cyklické dianionty odpovídající vzorci (CO) 2−
n je deltát aromatický a díky tomu poměrně stálý.[1]
Analogy
editovatAnalogem deltátu je anion odvozený náhradou tří kyslíkových atomů (=O a −O−) kyaniminovými skupinami (=N−C≡N nebo −N=C=N−), čímž vzniká symetrický anion se vzorcem C3(NCN) 2-
3 .[2]
Pokud jsou kyslíky nahrazeny dikyanomethylenovými (=C(CN)2) skupinami, tak vzniká oxidující sloučenina, která se snadno redukuje na stabilní radikálový anion a dianion.[3]
Příprava
editovatKyselinu deltovou lze připravit fotolýzou bis(trimethylsilyl)esteru kyseliny kvadrátové ultrafialovým zářením a rozkladem vzniklého produktu butanolem.[4]
Tato látka může vznikat i reakcí stříbrné soli kyseliny kvadrátové s trimethylsilylchloridem.[1][5]
Deltátový anion je možné získat i přímou cyklotrimerizací oxidu uhelnatého za pokojové teploty; oxid uhelnatý rozpuštěný v pentanu reaguje s komplexem uranu za vzniku deltátového iontu navázaného na dva atomy uranu.[6]
Odkazy
editovatReference
editovatV tomto článku byl použit překlad textu z článku Deltic acid na anglické Wikipedii.
- ↑ a b c d e David Eggerding; Robert West. Synthesis and properties of deltic acid (dihydroxycyclopropenone) and the deltate ion. Journal of the American Chemical Society. 1976, s. 3641–3644. DOI 10.1021/ja00428a043.
- ↑ Johannes Beck; Petra Krieger-Beck. Crystal structure of 1,2-bis(cyanoimino)-3-triethylammonio-cyclopropenylide. Analytical Sciences. 2006, s. x239. DOI 10.2116/analscix.22.x239.
- ↑ T. Fukunaga. Negatively substituted trimethylenecyclopropane dianions. Journal of the American Chemical Society. 1976, s. 610–611. DOI 10.1021/ja00418a050.
- ↑ David Eggerding; Robert West. Synthesis of dihydroxycyclopropenone (deltic acid). Journal of the American Chemical Society. 1975, s. 207–208. DOI 10.1021/ja00834a047.
- ↑ M. T. Reetz; G. Neumeier; M. Kaschube. Thermische Umlagerung von Quadratsäure-Bis(trimethylsilyl)ester. Tetrahedron Letters. 1975, s. 1295. DOI 10.1016/S0040-4039(00)72653-0.
- ↑ O. T. Summerscales; F. G. N. Cloke; P. B. Hitchcock; J. C. Green; N. Hazari. Reductive cyclotrimerization of carbon monoxide to the deltate dianion by an organometallic uranium complex. Science. 2006, s. 829–831. DOI 10.1126/science.1121784. PMID 16469921. Bibcode 2006Sci...311..829S.
Související články
editovatExterní odkazy
editovat- Obrázky, zvuky či videa k tématu Kyselina deltová na Wikimedia Commons