Dusitanové komplexy kovů
Dusitanové komplexy kovů jsou komplexní sloučeniny obsahující jeden nebo více dusitanových (NO −
2 ) ligandů.[2]
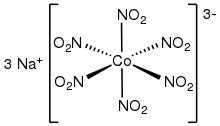
Syntetické dusitanové komplexy jsou předměty pouze akademického zájmu, tento druh komplexů se ale vyskytuje také v některých enzymech účastnících se koloběhu dusíku.[3]
Struktura
editovatVazby
editovatMnoho dusitanových ligandů má tři vazebné izomery, kde jeden je vázán přes O, druhý přes N a třetí bidentátně přes O,O. U pentamminkobaltitých komplexů byly zjištěny první dva, [(NH3)5Co-NO2]2+ (N-nitrito) a [(NH3)5Co-ONO]2+ (O-nitrito). První forma bývá někdy nazývána nitro a druhá nitrito. Některé dusitanové komplexy, například [Cu(bipy)2(O2N)]NO3 (bipy je 2,2′-bipyridylový ligand), mají chelatační účinky.
O-vázané a N-vázané jednokovové komplexy se chovají jako jednoelektronové pseudohalogenidy (X-ligandy). Bidentátní O,O-vázané sloučeniny mají L-X ligandy, podobné karboxylátům.
Podle teorie HSAB jsou N-vázané komplexy častější u měkčích kovů. O- a O,O-bidentátní vazby se vyskytují u tvrdých ligandů, na Lewisovsky kyselých kovových centrech.
Kineticky výhodný O-vázaný izomer [(NH3)5Co-ONO]2+ se dá přeměnit na [(NH3)5Co-NO2]2+. Jeho reakcí s železitými porfyrinovými sloučeninami vzniká O-vázaný komplex Fe(porph)ONO. Přidání donorových ligandů na tento komplex způsobí tvorbu oktaedrického nízkospinového izomeru, který funguje jako Lewisova kyselina. Dusitan se izomeruje na N-vázaný izomer, Fe(porph)NO2(L).[4]
Izomerizace [(NH3)5Co-ONO]2+ na [(NH3)5Co-NO2]2+ probíhá vnitromolekulárně.[5]
Homoleptické komplexy
editovatNěkolik homoleptických (obsahujících ligandy jediného druhu) dusitanových komplexů bylo zkoumáno rentgenovou krystallografií. Patří k nim oktaedrické komplexy [M(NO2)6]3− (M = Co, Rh).[6][7] Čtvercové homoleptické komplexy jsou známy také u Pt2+ a Pd2+. Draselné soli [M(NO2)4]2− (M = Zn, Cd) obsahují čtyři O,O-bidentátní dusitanové ligandy.[8]
Příprava
editovatDusitanové komplexy se nejčastěji připravují podvojnými záměnami pomocí dusitanů alkalických kovů, například dusitanu sodného. Při neutrálním pH se dusitany vyskytují převážně jako anionty.[9]
Nitrosylkomplexy se v zásaditých roztocích hydrolyzují za tvorby dusitanových komplexů, což lze ukázat například na nitroprusidech:
- [Fe(CN)5NO]2− + 2 OH- → [Fe(CN)5NO2]4− + H2O
Reakce
editovatNěkteré aniontové komplexy se působením kyselin deoxygenují za vzniku nitrosylů;[10]
- [LnMNO2]- + H+ → [LnMNO]+ + OH−
někdy jsou takové reakce vratné a zásaditou hydrolýzou elektrofilního nitrosylu lze získat zpět dusitanový komplex.
Nitrokomplexy mohou katalyzovat oxidace alkenů.[11]
Bioanorganická chemie
editovatDusitanové komplexy se účastní koloběhu dusíku, kde se mezi sebou přeměňují amoniak a dusičnany. Samotné dusitany nevstupují snadno do redoxních reakcí, ale jejich komplexy s kovy jsou reaktivnější.[12]
Oxidace na dusičnany
editovatEnzym nitritoxidoreduktáza, obsahující molybden, katalyzuje oxidaci dusitanů na dusičnany:
- NO −
2 + H2O → NO −
3 + 2 H+
Redukce
editovatHemový enzym nitritreduktáza přeměňuje dusitany na amoniak. Katalytický cyklus začíná redukcí dusitanového komplexu železa na nitrosylový komplex.[3]
Cu-nitritreduktáza (CuNIR) katalyzuje 1elektronovou redukci dusitanů na oxid dusnatý. Navržený mechanismus spočívá v protonaci komplexu κ2O,O-NO2-Cu+. Poté nastává štěpení vazby N–O, kterým se vytváří HO–Cu–ON centrum, obsahující oxid dusnatý navázaný na měďnatý ion přes O (jako isonitrosyl).
Reference
editovatV tomto článku byl použit překlad textu z článku Transition metal nitrite complex na anglické Wikipedii.
- ↑ FIGGIS, B. N.; SOBOLEV, A. N. Na3Co(NO2)6 at 293 and 10 K. Acta Crystallographica Section C: Crystal Structure Communications. 2001-08-15, roč. 57, čís. 8, s. 885–886. Dostupné online [cit. 2022-12-13]. ISSN 0108-2701. DOI 10.1107/S0108270101007995. (anglicky)
- ↑ Michael A. Hitchman; Graham L. Rowbottom. Transition Metal Nitrite Complexes. Coordination Chemistry Reviews. 1982, s. 55–132. DOI 10.1016/S0010-8545(00)80527-5.
- ↑ a b A. J. Timmons; M. D. Symes. Converting between the Oxides of Nitrogen Using Metal–Ligand Coordination Complexes. Chemical Society Reviews. 2015, s. 6708–6722. DOI 10.1039/C5CS00269A. PMID 26158348.
- ↑ Peter C. Ford. Reactions of NO and Nitrite with Heme Models and Proteins. Inorganic Chemistry. 2010, s. 6226–6239. DOI 10.1021/ic902073z. PMID 20666383.
- ↑ W. Gregory Jackson; Geoffrey A. Lawrance; Peter A. Lay; Alan M. Sargeson. Base-catalyzed nitrito to Nitro Linkage Isomerization of Cobalt(III), Rhodium(III), and Iridium(III) Pentaammine Complexes. Inorganic Chemistry. 1980, s. 904–910. DOI 10.1021/ic50206a022.
- ↑ R. Bianchi; C. Gatti; V. Adovasio; M. Nardelli. Theoretical and experimental (113 K) electron-density study of lithium bis(tetramethylammonium) hexanitrocobaltate(III). Acta Crystallographica Section B: Structural Science. 1996, s. 471–478. DOI 10.1107/S0108768195016879.
- ↑ V. Adovasio; F. Lina; M. Nardelli; G. Pelizzi. Lithium bis(tetramethyllammonium) Hexanitrocobaltate(III) at 113 and 293 K. Acta Crystallographica Section C: Crystal Structure Communications. 1994, s. 871–874. DOI 10.1107/S0108270193011588.
- ↑ S. Ohbao; F. Matsumoto; H. Takazawa; Y. Saito. Structures of cadmium nitrite dihydrate and cadmium dipotassium tetranitrite. Acta Crystallographica Section C: Crystal Structure Communications. 1987, s. 191–194. DOI 10.1107/S0108270187096471.
- ↑ Edward P. Harbulak; Marvin J. Albinak. cis -Dinitrobis(ethylenediamine)cobalt(III) Nitrite and Nitrate. Inorganic Syntheses. 1966, s. 196–198. ISBN 9780470132395. DOI 10.1002/9780470132395.ch51.
- ↑ GREENWOOD, Norman N.; EARNSHAW, Alan. Chemistry of the elements. 2nd ed.. vyd. [s.l.]: Butterworth-Heinemann, 1997. ISBN 978-0-08-037941-8. S. 449.
- ↑ Ian J. S. Fairlamb. Redox-Active NOx Ligands in Palladium-Mediated Processes. Angewandte Chemie International Edition. 2015, s. 10415-10427. DOI 10.1002/anie.201411487. PMID 26211412.
- ↑ Luisa B. Maia; José J. G. Moura. How Biology Handles Nitrite. Chemical Reviews. 2014, s. 5273–5357. DOI 10.1021/cr400518y. PMID 24694090.