Benzylalkohol
Benzylalkohol je organická sloučenina se vzorcem C6H5CH2OH. Jedná se o bezbarvou kapalinu se slabou aromatickou vůní. Tato látka se často používá jako rozpouštědlo, a to díky své polaritě, nízké toxicitě a nízkému tlaku syté páry. Benzylalkohol se slabě rozpouští ve vodě (kolem 4 g/100 ml) a mísí se s alkoholy a diethyletherem. Anion vzniklý deprotonací alkoholové skupiny benzylalkoholu se nazývá benzylát nebo benzyloxid.
| Benzylalkohol | |
|---|---|
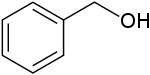 Strukturní vzorec | |
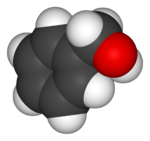 Model molekuly | |
| Obecné | |
| Systematický název | fenylmethanol |
| Ostatní názvy | fenylmethylalkohol, E 1519 |
| Sumární vzorec | C7H8O |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 100-51-6 |
| PubChem | 244 |
| SMILES | c1ccc(cc1)CO |
| InChI | InChI=1/C7H8O/c8-6-7-4-2-1-3-5-7/h1-5,8H,6H2 |
| Vlastnosti | |
| Molární hmotnost | 108,14 g/mol |
| Teplota tání | −15,2 °C (258,0 K) |
| Teplota varu | 205,3 °C (478,4 K) |
| Hustota | 1,044 g/cm3 |
| Index lomu | 1,5396 |
| Disociační konstanta pKa | 15,40 |
| Rozpustnost ve vodě | 3,50 g/100 ml (20 °C) 4,29 g/100 ml (25 °C) |
| Rozpustnost v polárních rozpouštědlech | rozpustný v methanolu, ethanolu a acetonu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru, chloroformu a benzenu |
| Tlak páry | 180 Pa (60 °C) |
| Měrná magnetická susceptibilita | −6,64×105 μm3/g |
| Struktura | |
| Dipólový moment | 1,67 D |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −352 kJ/mol |
| Bezpečnost | |
| [1] Varování[1] | |
| Teplota vzplanutí | 93 °C (366 K) |
| Teplota vznícení | 436 °C (709 K) |
| Meze výbušnosti | 1,3 až 13 % |
Některá data mohou pocházet z datové položky. | |
Výskyt
editovatBenzylalkohol se přirozeně vytváří v mnoha rostlinách a často se vyskytuje v ovoci. Rovněž je obsažen v silicích mnoha rostlin, jako jsou například jasmín, hyacint a ylang-ylang. Obsahuje jej též kastoreum.[2]
Výroba
editovatBenzylalkohol se vyrábí hydrolýzou benzylchloridu za přítomnosti hydroxidu sodného:
- C6H5CH2Cl + NaOH → C6H5CH2OH + NaCl
Také se dá získat reakcí fenylmagnesiumbromidu s formaldehydem.
Reakce
editovatBenzylalkohol, podobně jako většina alkoholů, reaguje s karboxylovými kyselinami za vzniku esterů. V organické syntéze se benzylestery často používají jako chránicí skupiny, které lze odstranit mírnou hydrogenolýzou.[3]
Benzylalkohol reaguje s akrylonitrilem za tvorby N-benzylakrylamidu:[4]
- C6H5CH2OH + NCCHCH2 → C6H5CH2N(H)C(O)CHCH2
Použití
editovatBenzylalkohol je častým rozpouštědlem inkoustů, vosků, barev, laků a epoxidových pryskyřic a bývá tak součástí směsí na odstraňování nátěrů, obzvláště ve směsi s látkami zvyšujícími viskozitu, které usnadňují přichycení k natřenému povrchu.[5]
Také se používá jako prekurzor řady esterů, využívaných například při výrobě mýdel a parfémů. Často bývá součástí náplní elektronických cigaret, kde navyšuje obsah vůní. Při styku 10% benzylalkoholu s poškozenou kůží nebo sliznicí funguje jako lokální anestetikum a antimikrobiální látka. Slouží také jako odmašťovací přísada v prostředcích na čištění koberců. Jakožto rozpouštědlo barev benzylalkohol usnadňuje barvení vlny, nylonu a kůže.[6] Může být také součástí repelentů.
V nanotechnologiích
editovatBenzylalkohol se používá jako dielektrické rozpouštědlo při dielektroforetické rekonfiguraci nanovláken.[7][8]
Ve zdravotnictví
editovatBenzylalkohol může být při nízkých koncentracích použit jako bakteriostatický konzervant u nitrožilních a povrchových léků a také v kosmetice; zabraňuje zavírání průduchů u vší, které se tak ucpou vodou nebo olejem a vši se tak udusí. Obvyklá koncentrace je 5 %.
Ostatní použití
editovatBenzylalkohol má téměř stejný index lomu jako křemen a vlna; pokud se předmět z čistého křemene ponoří do benzylalkoholu, stane se téměř neviditelným, což lze využít k ověření, zda je tvořen skutečným křemenem. Obdobně vlna ponořená do benzylalkoholu také téměř přestane být viditelná, čímž je možné odhalit nečistoty jako jsou rostlinné materiály.
Bezpečnost
editovatBenzylalkohol má nízkou akutní toxicitu, smrtelná dávka u krys je přibližně 1,2 g/kg[9] Rychle se oxiduje na kyselinu benzoovou, která v játrech reaguje s glycinem a vylučuje se jako kyselina hippurová. Vysoké koncentrace mohou vést k toxickým účinkům, kterými jsou selhání dechu, vazodilatace, nízký krevní tlak, křeče a ochrnutí.
Benzylalkohol silně dráždí oči,[9] v čisté podobě způsobuje odumírání rohovky.[10]
Benzylalkohol není považován za karcinogen a nejsou u něj potvrzené ani teratogenní účinky nebo reprodukční toxicita.[9]
Reference
editovatV tomto článku byl použit překlad textu z článku Benzyl alcohol na anglické Wikipedii.
- ↑ a b Benzyl alcohol. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Dietland Muller-Schwarze. The Beaver: Its Life and Impact. [s.l.]: [s.n.], 2003. Dostupné online. S. 43.
- ↑ FURUTA, Kyoji; GAO, Qing-Zhi; YAMAMOTO, Hisashi. Chiral (Acyloxy)borane Complex-Catalyzed Asymmetric Diels-Alder Reaction: (1R)-1,3,4-Trimethyl-3-Cyclohexene-1-Carboxaldehyde. Org. Synth.. 1995, s. 86. Dostupné online.; Coll. Vol.. S. 722.
- ↑ PARRIS, Chester L. N-benzylacrylamide. Org. Synth.. 1962, s. 16. Dostupné online.; Coll. Vol.. S. 73.
- ↑ Benzyl alcohol [online]. chemicalland21.com [cit. 2019-05-14]. Dostupné v archivu pořízeném dne 2009-04-21.
- ↑ Michael Ash; Irene Ash. Handbook of Preservatives. [s.l.]: Synapse Info Resources, 2004. Dostupné online. ISBN 978-1-890595-66-1. S. 292.
- ↑ Alex Wissner-Gross. Dielectrophoretic reconfiguration of nanowire interconnects. Nanotechnology. 2006, s. 4986–4990. Dostupné online.[nedostupný zdroj]
- ↑ Nanowires get reconfigured [online]. Nanotechweb.org, 19.10. 2006 [cit. 2019-05-15]. Dostupné v archivu pořízeném dne 2010-10-28.
- ↑ a b c Friedrich Brühne; Elaine Wright. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: John Wiley & Sons, 2007. S. 7–8.
- ↑ Swarupa G. Kulkarni; Harihara M. Mehendale. Encyclopedia of Toxicology. 2. vyd. [s.l.]: Elsevier, 2005. S. 262–264.
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu benzyl alkohol na Wikimedia Commons
