Valenční elektron
Valenční elektron je elektron v elektronovém obalu atomu umístěný ve valenční, energeticky nejvýše položené vrstvě nebo několika vrstvách. Elektrony se nacházejí ve valenčních orbitalech, největších orbitalech atomu.
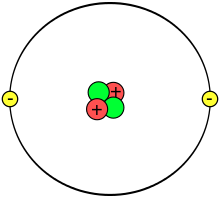
Valenční elektrony se při kontaktu s jinými atomy podílejí na vzniku chemických vazeb mezi atomy. Jsou proto nejdůležitější součástí elektronové konfigurace atomu, která určuje chemické vlastnosti daného prvku.
Počet valenčních elektronů editovat
Počet elektronů ve valenční slupce je specifický pro daný chemický prvek. Podle něj jsou prvky rozděleny do sloupců periodické tabulky a označují se jako skupiny. Skupiny prvků v periodické soustavě jsou očíslovány I.A až VIII.A a I.B až VIII.B. Číslo skupiny odpovídá počtu valenčních elektronů (s výjimkou části skupiny VIII.B a skupin I.B a II.B). Modernější očíslování skupin 1 až 18 s počtem valenčních elektronů souvisí jen u menší části prvků. Počet valenčních elektronů většinou určuje maximální oxidační číslo atomu.
Chemické prvky se podle umístění jejich valenčních elektronů v orbitalech dělí na s, p, d a f-prvky. Například orbital s může obsahovat maximálně dva elektrony, orbital p šest elektronů. Zápis 1s2 označuje orbital s první slupky se dvěma elektrony, 2p2 označuje orbital p druhé slupky se dvěma elektrony.
| Pořadí | Prvek | Struktura elektronového obalu | Zápis pomocí vzácného plynu | Valenční elektrony |
|---|---|---|---|---|
| 1 | Vodík | 1s1 | 1s1 | 1s1 |
| 2 | Helium | 1s2 | He | 1s2 |
| 3 | Litium | 1s2 2s1 | He 2s1 | 2s1 |
| 4 | Berylium | 1s2 2s2 | He 2s2 | 2s2 |
| 5 | Bór | 1s2 2s2 2p1 | He 2s2 2p1 | 2s2 2p1 |
| 6 | Uhlík | 1s2 2s2 2p2 | He 2s2 2p2 | 2s2 2p2 |
| 7 | Dusík | 1s2 2s2 2p3 | He 2s2 2p3 | 2s2 2p3 |
| 8 | Kyslík | 1s2 2s2 2p4 | He 2s2 2p4 | 2s2 2p4 |
| 9 | Fluor | 1s2 2s2 2p5 | He 2s2 2p5 | 2s2 2p5 |
| 10 | Neon | 1s2 2s2 2p6 | Ne | 2s2 2p6 |
Osmá skupina prvků, vzácné nebo inertní plyny, je skupina prvků se zcela zaplněnou valenční slupkou. Jejich atomy jsou proto stabilní a za obvyklých podmínek nereagují mezi sebou ani s ostatními prvky. Ty se naopak snaží nabýt jejich elektronovou strukturu a doplnit svou valenční slupku na jejich hodnotu, tedy osm elektronů (kromě prvního helia se dvěma elektrony).
| Vzácný plyn | Helium | Neon | Argon | Krypton | Xenon | Radon |
|---|---|---|---|---|---|---|
| Valenční slupka | 1s2 | 2s2p6 | 3s2p6 | 4s2p6 | 5s2p6 | 6s2p6 |
Dělení chemických prvků editovat
Chemické prvky se dělí na s, p, d a f-prvky podle umístění jejich valenčních elektronů v orbitalech.
Nepřechodné prvky editovat
Prvky s a p se také nazývají nepřechodné prvky, jejich valenční elektrony (nebo orbitaly) jsou pouze v jediné – poslední vrstvě (slupce) obalu atomu – jde o skupiny I.A (1) až VIII.A (17) a počet valenčních elektronů (orbitalů) těchto prvků odpovídá číslu skupiny.
Přechodné prvky editovat
Jako přechodné prvky se označují d-prvky. Jejich valenční elektrony (orbitaly) zahrnují poslední a část předposlední vrstvy obalu atomu, jde o skupiny I.B až VIII.B (3 až 10). Zde číslo skupiny odpovídá počtu valenčních elektronů jen u části prvků.
Vnitřně přechodné prvky editovat
Jako vnitřně přechodné se označují f-prvky, které mají valenční elektrony (orbitaly) v posledních třech vrstvách obalu atomu. Obecně je elektronová konfigurace valenčních elektronů s-prvků ns1,2, p-prvků ns2, np1 až 6, d-prvků ns2, (n−1)d1 až 10, kde n je číslo poslední vrstvy obalu atomu (číslo periody, v níž je prvek v periodické soustavě prvků, nejvyšší hodnota kvantového čísla orbitalů daného atomu). Rozdělení prvků za pomoci typu valenčních orbitalů je možné konkretizovat až na označení jednotlivých skupin (sloupců) prvků periodické soustavy. Jsou tak známy s1 a s2 prvky, p1 až p6 prvky, d1 až d10 prvky a f1 až f14 prvky.
Chemická vazba editovat
V periodické tabulce prvků objevené D. I. Mendělejevem se prvky nacházejí v určitém řádku (periodě) a sloupci (skupině). Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody a počet valenčních elektronů se shoduje s číslem skupiny,
Poloha prvku v periodické tabulce určuje jeho elektronovou konfiguraci a tím počet valenčních elektronů. Právě valenční elektrony jsou odpovědné za chemické vlastnosti atomu nebo molekuly a velmi významné pro jejich chemické vazby.
Každý prvek se snaží zcela zaplnit svou valenční slupku na maximální počet elektronů, tedy stejně jako ji mají zaplněnou prvky osmé skupiny - vzácné plyny. Na obrázku je příklad fluoru, který má ve valenční slupce sedm elektronů (červené body na valenční slupce), a sodíku, který má ve valenční slupce jeden elektron. Je zřejmé, že pro fluor to učiní přijmutím elektronu a sodík naopak elektron odevzdá. Tak oba získají maximální počet elektronů ve valenční slupce, tedy osm - elektronový oktet, stejně jako neon.
Kovalentní vazba editovat
Hlavní typ chemické vazby, kovalentní vazba, se vytváří především z nespárovaných valenčních elektronů, tedy těch, které jsou ve valenčních orbitalech umístěné jednotlivě. Prvek tak nemusí (a někdy ani nemůže) využít pro tvorbu kovalentních vazeb všechny valenční elektrony. Příkladem takových prvků jsou vzácné plyny (třeba He), které mají valenční elektrony v orbitalech výhradně spárované a mohou je jen výjimečně rozdělit. Helium a neon proto téměř netvoří chemické vazby.
Iontová vazba editovat
Některé prvky mohou část nebo všechny valenční elektrony odštěpit a vytvořit kationty (zejména reaktivní kovy), reaktivní nekovy mohou do valenčních orbitalů naopak elektrony přijmout a vytvořit anionty. Tato schopnost souvisí s elektronegativitou prvku, při velkém rozdílu elektronegativit mezi vázanými atomy vzniká iontová vazba.
Související články editovat
Literatura editovat
- Zdeněk Opava: Chemie kolem nás. Praha: Albatros, 1986, 13-751-86
Externí odkazy editovat
- Obrázky, zvuky či videa k tématu Valenční elektron na Wikimedia Commons
Reference editovat
V tomto článku byly použity překlady textů z článků Valence electron na anglické Wikipedii a Valenzelektron na německé Wikipedii.