Neopentan
Neopentan, systematický název 2,2-dimethylpropan[2], je uhlovodík z řady alkanů, jeden z izomerů pentanu (společně s pentanem („n-pentanem“) a isopentanem). Je to extrémně hořlavá látka, která je za standardních podmínek v plynném skupenství, jako jediný uhlovodík s více než 4 atomy uhlíku. Při teplotách pod 10 °C kondenzuje na velmi těkavou kapalinu.
| Neopentan | |
|---|---|
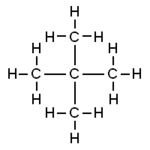 strukturní vzorec | |
 tyčinkový model molekuly | |
 kalotový model molekuly | |
| Obecné | |
| Systematický název | 2,2-dimethylpropan |
| Ostatní názvy | dimethylpropan |
| Anglický název | neopentane |
| Německý název | Neopentan |
| Funkční vzorec | C(CH3)4 |
| Sumární vzorec | C5H12 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 463-82-1 |
| PubChem | 10041 |
| SMILES | CC(C)(C)C |
| InChI | InChI=1S/C5H12/c1-5(2,3)4/h1-4H3 |
| Vlastnosti | |
| Molární hmotnost | 72,15 g/mol |
| Teplota tání | −16,6 °C (256,4 K) |
| Teplota varu | 9,5 °C (282,6 K) |
| Hustota | 0,586 g/cm3 |
| Rozpustnost ve vodě | nerozpustný |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −168,5 až −167,3 kJ/mol |
| Standardní molární spalná entalpie ΔH°sp | −3,515 06 až −3,513 14 MJ/mol |
| Standardní molární entropie S° | 217 J⋅K−1⋅mol−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R12 R52/53 |
| S-věty | S2 S16 S33 |
Některá data mohou pocházet z datové položky. | |
Neopentan je také nejjednodušší alkan s kvartérním atomem uhlíku, tedy takovým, na který není přímo navázán žádný atom vodíku, ale ve všech čtyřech pozicích je substituován alkyly, v tomto případě methylovými skupinami.
Vlastnosti
editovatTeplota varu neopentanu je kolem 9,5 °C, což je mnohem méně než u isopentanu (27,7 °C) nebo n-pentanu (36,0 °C). Teplota tání (−16,6 °C) je více než 140 °C vyšší oproti isopentanu (−159,9 °C) a o více než 110 °C vyšší oproti n-pentanu (−129,8 °C).
Reference
editovatV tomto článku byl použit překlad textu z článku Neopentane na anglické Wikipedii.
- ↑ a b Neopentane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ používá se též jen dimethylpropan, protože jiný izomer dimethylpropanu neexistuje
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Neopentan na Wikimedia Commons

