Duffova reakce
Duffova reakce, také nazývaná hexaminová aromatická formylace, je organická reakce patřící mezi formylace, pomocí níž se připravují benzaldehydy s využitím urotropinu jako zdroje karbonylového uhlíku.[1][2][3][4][5][6] Objevil ji britský chemik James Cooper Duff, po kterém je také pojmenována.
Tato reakce patří mezi elektrofilní aromatické substituce. Elektrofilem je zde iminiový ion CH2+NR2, který je následně hydrolyzován na aldehyd. Pro tuto reakcí je nutné, aby byly na aromatické jádro navázány silné donory elektronů, jako je hydroxylová skupina. Formylace přednostně probíhá do polohy ortho vzhledem k donoru elektronů. Pokud je tato poloha blokována, pak se substituent naváže do polohy para.[7]
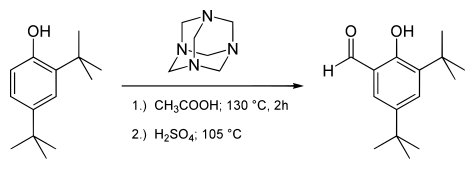
Příklady sloučenin získávaných Duffovou reakcí jsou 3,5-di-terc-butylsalicylaldehyd:[8]

Mechanismus
editovatNa níže uvedeném obrázku je znázorněn mechanismus Duffovy reakce popisující, jak v několika krocích hexamethylentetramin poskytuje methinovou skupinu aromatickému substrátu skrz řadu reakcí, přičemž se vytváří iminiový ion, který je meziproduktem reakce. Následná adice na benzenové jádro vede k vytvoření meziproduktu, který má stejný oxidační stav jako benzylamin. Poté dojde k vnitromolekulární reakci, která má za následek oxidaci uhlíkového atomu na úroveň odpovídající benzaldehydu. Nakonec proběhne kyselá hydrolýza, při které se na molekulu připojí atom kyslíku:
Odkazy
editovatSouvisející články
editovat- Bouveaultova syntéza aldehydů
- Bodrouxova–Čičibabinova syntéza aldehydů
- Reimerova–Tiemannova reakce
- Sommeletova reakce
- Vilsmeierova-Haackova reakce
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Duffova reakce na Wikimedia Commons
Reference
editovatV tomto článku byl použit překlad textu z článku Duff reaction na anglické Wikipedii.
- ↑ J. C. Duff; E. J. Bills. 273. Reactions between hexamethylenetetramine and phenolic compounds. Part I. A new method for the preparation of 3- and 5-aldehydosalicylic acids. Journal of the Chemical Society. 1932, s. 1987.
- ↑ J. C. Duff; E. J. Bills. 282. Reactions between hexamethylenetetramine and phenolic compounds. Part II. Formation of phenolic aldehydes. Distinctive behaviour of p-nitrophenol. Journal of the Chemical Society. 1934, s. 1305.
- ↑ J. C. Duff; E. J. Bills. 96. A new general method for the preparation of o-hydroxyaldehydes from phenols and hexamethylenetetramine. Journal of the Chemical Society. 1941, s. 547.
- ↑ J. C. Duff; E. J. Bills. 71. A new method for the preparation of p-dialkylaminobenzaldehydes. Journal of the Chemical Society. 1945, s. 276.
- ↑ Lloyd Noel Ferguson. The Synthesis of Aromatic Aldehydes. Chemical Reviews. 1946, s. 227–254. PMID 21024865.
- ↑ Y. Ogata; F. Sugiura. Kinetics and mechanism of the Duff reaction. Tetrahedron. 1968, s. 5001.
- ↑ Mundy, Bradford P.; Ellerd, Michael G.; Favaloro, Frank G. (2005). Name Reactions and Reagents in Organic Synthesis, 2nd Edition, John Wiley & Sons, pp. 222 – 223.
- ↑ LARROW, Jay F.; JACOBSEN, Eric N. (R,R)-N,N'-Bis(3,5-di-tert-butylsalicylaldehyde)-1,2-cyclohexanediamino Manganese(III) Chloride, a Highly Enantioselective Epoxidation Catalyst. Org. Synth.. 1998, s. 1. Dostupné online. DOI 10.15227/orgsyn.075.0001.; Coll. Vol.. S. 96.
- ↑ ALLEN, C. F. H.; LEUBNER, Gerhard W. Syringic aldehyde. Org. Synth.. 1951, s. 92. Dostupné online. DOI 10.15227/orgsyn.031.0092.; Coll. Vol.. S. 866.