Chlorid zlatitý
Chlorid zlatitý (chemický vzorec AuCl3) je nejběžnější sloučeninou zlata. Z českého chemického názvosloví vyplývá, že je zlato v této sloučenině v oxidačním čísle III+. Existují ještě dvě sloučeniny zlata s chlorem, chlorid zlatný a kyselina chlorozlatitá.
| Chlorid zlatitý | |
|---|---|
 Roztok | |
 Strukturní vzorec | |
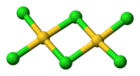 3D vzorec | |
| Obecné | |
| Systematický název | Chlorid zlatitý |
| Anglický název | Gold(III) chloride |
| Německý název | Gold(III)-chlorid |
| Sumární vzorec | AuCl3, Au2Cl6 (dimer) |
| Vzhled | Červená hygroskopická pevná látka |
| Identifikace | |
| Registrační číslo CAS | 13453-07-1 |
| Číslo RTECS | MD5420000 |
| Vlastnosti | |
| Molární hmotnost | 303,326 g/mol |
| Teplota tání | 288 °C (od 185 °C pozvolný rozklad) |
| Teplota sublimace | 265 °C |
| Hustota | 4,67 g/cm3 |
| Rozpustnost ve vodě | 68 g/100 g |
| Měrná magnetická susceptibilita | 4,65×10−6cm3g−1 |
| Struktura | |
| Krystalová struktura | jednoklonná |
| Koordinační geometrie | čtvercově rovinná |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −118,4 kJ/mol |
| Standardní molární entropie S° | 164,4 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −53,6 kJ/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R34, R36/37/38 |
| S-věty | S26, S36, S36/37/39 |
Některá data mohou pocházet z datové položky. | |
Příprava
editovatChlorid zlatitý se nejčastěji připravuje přímou chlorací čistého zlata za vysokých teplot:
- 2 Au + 3 Cl2 → 2 AuCl3
Vlastnosti
editovatBezvodý chlorid zlatitý se již za teploty okolo 160 °C rozkládá v chlorid zlatný. Touto reakcí se dá připravovat čisté zlato, protože chlorid zlatný se následně za teploty okolo 420 °C rozkládá na zlato a zpět na chlorid zlatitý (dochází k disproporcionaci):
- AuCl3 → AuCl + Cl2
- 3 AuCl → AuCl3 + 2 Au
Reakcí s vodným roztokem kyseliny chlorovodíkové vzniká komplexní sloučenina nazývaná kyselina chlorozlatitá:[2]
- HCl (aq) + AuCl3 (aq) → HAuCl4 (aq)
Obdobně probíhá reakce chloridu zlatitého s chloridy, produktem jsou poté příslušné chlorozlatitany.
Struktura molekuly
editovatChlorid zlatitý existuje, podobně jako bromid zlatitý, jako dimer. To znamená, že jeho molekula vypadá takto:
Použití
editovatChlorid zlatitý je nejběžnější chemickou sloučeninou zlata, pro přípravu ostatních sloučenin zlata bývá výchozí látkou. Připravuje se z něj např. komplexní sloučenina tetrakyanozlatitan draselný:
Chlorozlatité soli, hlavně tetrachlorozlatitan sodný, vznikající reakcí chloridu zlatitého a chloridu sodného, se používají jako katalyzátor při reakcích.
Ve fotografii se používá jako tónovací lázeň.
Odkazy
editovatReference
editovat- ↑ a b Gold trichloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ GREENWOOD, Norman Neill. Chemie prvků. Sv. 2.. 1. vyd. vyd. Praha: Informatorium 1635 s. s. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. S. 1467.
Související články
editovatExterní odkazy
editovat- Obrázky, zvuky či videa k tématu chlorid zlatitý na Wikimedia Commons
Literatura
editovat- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.

