Tetrathiafulvalen
Tetrathiafulvalen (zkráceně TTF) je organická sloučenina se vzorcem (H2C2S2C)2. Výzkum této heterocyklické sloučeniny vedl k rozvoji molekulární elektroniky. TTF je odvozen od uhlovodíku fulvalenu, (C5H4)2, náhradou čtyř CH skupin atomy síry. Bylo vydáno více než 10 000 vědeckých prací zabývajících se TTF a jeho deriváty.[2]
| Tetrathiafulvalen | |
|---|---|
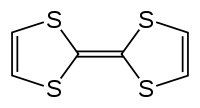 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 2,2’-Bi(1,3-dithiolyliden) |
| Ostatní názvy | Δ2,2-Bi-1,3-dithiol, TTF |
| Sumární vzorec | C6H4S4 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 31366-25-3 |
| EC-no (EINECS/ELINCS/NLP) | 250-593-7 |
| PubChem | 99451 |
| SMILES | C1=CSC(=C2SC=CS2)S1 |
| InChI | InChI=1S/C6H4S4/c1-2-8-5(7-1)6-9-3-4-10-6/h1-4H |
| Vlastnosti | |
| Molární hmotnost | 204,36 g/mol |
| Teplota tání | 116 až 119 °C (389 až 392 K) |
| Teplota varu | rozkládá se |
| Rozpustnost ve vodě | nerozpustný |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H317[1] |
| P-věty | P261 P272 P280 P302+352 P321 P333+313 P363 P501[1] |
Některá data mohou pocházet z datové položky. | |
Příprava
editovatZájem o TTF a jeho deriváty nastartoval rozvoj řady postupů jejich přípravy.[2] Většina metod se soustředí na spojování cyklických jednotek C3S2, jakými jsou například 1,3-dithiol-2-thiony nebo 1,3-dithiol-2-ony. Příprava samotného TTF začíná u trithiokarbonátu H2C2S2CS, který se S-methyluje a následně redukuje za vzniku H2C2S2CH(SCH3), jenž vstupuje do následujících reakcí:[3]
- H2C2S2CH(SCH)3 + HBF4 → [H2C2S2CH+]BF -
4 + HSCH3
- 2 [H2C2S2CH+]BF -
4 + 2 (C2H5)3N → (H2C2S2C)2 + 2 (C2H5)3NHBF4
Redoxní vlastnosti
editovatJiž samotný TTF má zajímavé elektrické vlastnosti; látkami s odlišnými vlastnostmi jsou však soli jeho oxidovaných derivátů, jako jsou soli iontu TTF+.
Vysokou elektrickou vodivost solí TTF způsobují tyto jeho vlastnosti: (i) rovinný tvar molekuly, umožňující π-π stabilizaci oxidovaných derivátů, (ii) vysoká symetrie molekuly, podporující delokalizaci elektrického náboje a tedy i omezení odpudivých coulombických sil, a (iii) schopnost TTF se oxidovat za nízkých potenciálů za tvorby stabilního radikálového kationtu. Elektrochemickými měřeními bylo zjištěno, že u TTF mohou proběhnout dvě zvratné oxidace:
- TTF → TTF+ + e− (E = 0,34 V)
- TTF+ → TTF +
2 + e− (E = 0,78 V, oproti Ag/AgCl v roztoku MeCN)
Každý dithiolylidenový kruh v TTF obsahuje 7 π elektronů: 2 na každém atomu síry a po 1 na sp2 uhlících. Oxidací se tak každý tento kruh mění na aromatický 6π-elektronový.
Historie
editovatV roce 1972 bylo zjištěno, že sůl [TTF+]Cl− má vlastnosti polovodiče.[5]
Následně se zjistilo, že sůl [TTF]TCNQ je také polovodivá.[6]
Při studiích [TTF][TCNQ] pomocí rentgenové krystalografie se objevily shluky částečně oxidovaných molekul TTF vedle aniontových shluků molekul TCNQ. Tato struktura byla neočekávaná a právě ona způsobuje rozdílné elektrické vlastnosti, jako je vysoká a anizotropní elektrická vodivost. Od těchto objevů bylo připraveno mnoho dalších analogů TTF; k nejlépe prozkoumaným patří tetramethyltetrathiafulvalen (Me4TTF), tetramethylselenafulvaleny (TMTSF) a bis(ethylendithio)tetrathiafulvalen (BEDT-TTF, CAS [66946-48-3]).[7] Některé soli tetramethyltetrathiafulvalenu (nazývané Fabreovy soli) je možné použít jako organické supravodiče.
Odkazy
editovatReference
editovatV tomto článku byl použit překlad textu z článku Tetrathiafulvalene na anglické Wikipedii.
- ↑ a b c d Tetrathiafulvalene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b M. Bendikov; F. Wudl; D. F. Perepichka. Tetrathiafulvalenes, Oligoacenenes, and Their Buckminsterfullerene Derivatives: The Brick and Mortar of Organic Electronics. Chemical Reviews. 2004, s. 4891–4945. DOI 10.1021/cr030666m. PMID 15535637.
- ↑ F. Wudl; M. L. Kaplan. 2,2'Bi-1,3-dithiolylidene (Tetrathiafulvalene, TTF) and Its Radical Cation Derivatives. Inorganic Syntheses. 1979, s. 27–30. ISBN 978-0-470-13250-0. DOI 10.1002/9780470132500.ch7.
- ↑ D. Chasseau; G. Comberton; J. Gaultier; C. Hauw. Réexamen de la structure du complexe hexaméthylène-tétrathiafulvalène-tétracyanoquinodiméthane. Acta Crystallographica Section B. 1978, s. 689. DOI 10.1107/S0567740878003830.
- ↑ F. Wudl; D. Wobschall; E. J. Hufnagel. Electrical Conductivity by the Bis(1,3-dithiole)-bis(1,3-dithiolium) System. Journal of the American Chemical Society. 1972, s. 670–672. DOI 10.1021/ja00757a079.
- ↑ J. Ferraris; D. O. Cowan; V. V. Walatka; J. H. Perlstein. Electron transfer in a new highly conducting donor-acceptor complex. Journal of the American Chemical Society. 1973, s. 948–949. DOI 10.1021/ja00784a066.
- ↑ LARSEN, J.; LENOIR, C. 2,2'-Bi-5,6-Dihydro-1,3-Dithiolo[4,5-b][1,4]dithiinylidene (BEDT-TTF). Org. Synth.. 1998. Dostupné online.; Coll. Vol.. S. 72.
Související články
editovatExterní odkazy
editovat- Obrázky, zvuky či videa k tématu Tetrathiafulvalen na Wikimedia Commons
