Hofmannův přesmyk
Hofmannův přesmyk (také Hofmannova degradace neboli Hofmannovo odbourávání je organická reakce, při níž se amid karboxylové kyseliny přeměňuje na primární amin, který má o jeden atom uhlíku méně.[1][2][3]
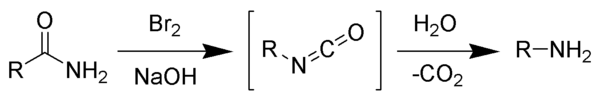
Mechanismus
editovatReakcí bromu s hydroxidem sodným vzniká bromnan sodný, který dále reaguje s primárním amidem za tvorby isokyanátového meziproduktu; ke vzniku nitrenového meziproduktu nedochází, jelikož by se musela tvořit také hydroxamová kyselina, což nebylo nikdy pozorováno. Isokyanát se následně hydrolyzuje na primární amin, přičemž dochází k uvolnění oxidu uhličitého.[2]
- Zásada odštěpí proton z vazby N-H za vzniku aniontu.
- Anion reaguje s bromem α-substituční reakcí za vzniku N-bromamidu.
- Odštěpením zbývajícího amidového protonu pomocí zásady se utváří bromamidový anion.
- Bromamidový anion se přesmykuje, skupina R se přesouvá z karbonylového uhlíku na dusík současně s odštěpením bromidového iontu, za tvorby isokyanátu.
- Proběhne nukleofilní adice vody na isokyanát za vzniku derivátu kyseliny karbamové.
- Z karbamátu se odštěpí oxid uhličitý a vznikne amin.
Obměny
editovatBrom lze při Hofmannově přesmyku nahradit několika jinými látkami, jako jsou například chlornan sodný,[4] octan olovičitý,[5] N-bromsukcinimid, (bis(trifluoracetoxy)jod)benzen,[6] a 1,8-diazabicyklo[5.4.0]undec-7-en (DBU) V níže zobrazeném příkladu je isokyanátový meziprodukt zachycen methanolem, čímž vzniká karbamát.[7]
K zachycení isokyanátu lze použít také terc-butylalkohol, v takovém případě se utváří amin chráněný terc-butyloxykarbonylovou skupinou.
Hofmannův přesmyk lze též použít k přípravě karbamátů z α,β-nenasycených či α-hydroxylovaných amidů[2][8] nebo nitrilů z α,β-acetylenových amidů.[2][9]
Při syntéze amiloridu se pro úspěšné provedení Hofmannova přesmyku používá kyselina bromná.
Použití
editovat- Přeměna alifatických i aromatických amidů na aminy
- Při přípravě kyseliny anthranilové z ftalimidu
- Přeměna kyseliny nikotinové na 3-aminopyridin
- Při syntéze gabapentinu se provádí monoamidace kyseliny 1,1-cyklohexandioctové amoniakem, po níž následuje Hofmannův přesmyk.
Odkazy
editovatReference
editovatV tomto článku byl použit překlad textu z článku Hofmann rearrangement na anglické Wikipedii.
- ↑ August Wilhelm von Hofmann. Ueber die Einwirkung des Broms in alkalischer Lösung auf Amide. Berichte der deutschen chemischen Gesellschaft. 1881, s. 2725–2736. (německy)
- ↑ a b c d Wallis Everett. The Hofmann Reaction. Organic Reactions. 1946, s. 267–306. ISBN 9780471005285. (anglicky)
- ↑ Takayuki Shioiri. Degradation Reactions. Comprehensive Organic Synthesis. 1991, s. 795–828. (anglicky)
- ↑ Ram S. Mohan; Keith A. Monk. The Hofmann Rearrangement Using Household Bleach: Synthesis of 3-Nitroaniline. The Journal of Organic Chemistry. 1975, s. 3554–3561. (anglicky)
- ↑ Henry Baumgarten; Howard Smith. Reactions of amines. XVIII. Oxidative rearrangement of amides with lead tetraacetate. Journal of Chemical Education. 1999, s. 1717. (anglicky)
- ↑ Merrick R. Almond; Julie B. Stimmel; Alan Thompson; Marc Loudon. Hofmann Rearrangement under Mildly Acidic Conditions using [I,I-Bis(Trifluoroacetoxy)]iodobenzene: Cyclobutylamine Hydrochloride from Cyclobutanecarboxamide. Organic Syntheses. 1988, s. 132. (anglicky)
- ↑ Jeffrey W. Keillor; Xicai Huang. Methyl Carbamate Formation via Modified Hofmann Rearrangement Reactions: Methyl N-(p-Methoxyphenyl)carbamate. Organic Syntheses. 2002, s. 234. (anglicky)
- ↑ R.A. Weerman. Einwirkung von Natriumhypochlorit auf Amide ungesättigter Säuren. Justus Liebigs Annalen der Chemie. 1913, s. 1–20. (německy)
- ↑ I.J. Rinkes. De l'action de l'Hypochlorite de Sodium sur les Amides D'Acides. Recueil des Travaux Chimiques des Pays-Bas. 1920, s. 704–710. (francouzsky)
Související články
editovatExterní odkazy
editovat- Obrázky, zvuky či videa k tématu Hofmannův přesmyk na Wikimedia Commons