Hexakyanoželezitany
Hexakyanoželezitany jsou soli aniontu se vzorcem [Fe(CN)6]3−; nejběžnější je hexakyanoželezitan draselný, červená krystalická látka používaná v organické chemii jako oxidační činidlo.[1]
| Hexakyanoželezitany | |
|---|---|
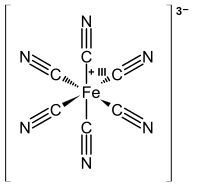 Strukturní vzorec hexakyanoželezitanového aniontu | |
 Modely molekuly | |
| Obecné | |
| Funkční vzorec | [Fe(CN6)]3− |
| Sumární vzorec | FeC6N 3- 6 |
| Identifikace | |
| Registrační číslo CAS | 13408-62-3 |
| PubChem | 439210 |
| ChEBI | 5020 |
| SMILES | N#C[Fe-3](C#N)(C#N)(C#N)(C#N)C#N |
| InChI | InChI=1S/6CN.Fe/c6*1-2;/q6*-1;+3 |
| Vlastnosti | |
| Molární hmotnost | 211,95 g/mol |
Některá data mohou pocházet z datové položky. | |
Vlastnosti
editovat[Fe(CN)6]3− se skládá z centra tvořeného železitým iontem (Fe3+), na které se váže šest kyanidových ligandů v oktaedrické geometrii. Grupa symetrie komplexu je Oh. Komplex je nízkospinový a snadno se redukuje na hexakyanoželeznatanový ion [Fe(CN)6]4−. Tato přeměna je vratná a nedochází při ní k tvorbě nových ani zániku starých vazeb Fe–C:
- [Fe(CN)6]3− + e− ⇌ [Fe(CN)6]4−
Tento redoxní pár slouží jako standard v elektrochemii.
Oproti jednoduchým kyanidům, jako například draselnému, jsou hexakyanoželezitany mnohem méně toxické, což je způsobeno silnější vazbou mezi kyanidovým iontem (CN−) a Fe3+, ale mohou reagovat s minerálními kyselinami za uvolnění kyanovodíku.
Použití
editovatReakcemi hexakyanoželezitanů se železnatými solemi vzniká berlínská modř, používaná jako barvivo v diazotypii.
Odkazy
editovatReference
editovatV tomto článku byl použit překlad textu z článku Ferricyanide na anglické Wikipedii.
- ↑ GAIL, Ernst; GOS, Stephen; KULZER, Rupprecht. Cyano Compounds, Inorganic. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a08_159.pub3. S. a08_159.pub3. (anglicky) DOI: 10.1002/14356007.a08_159.pub3.
Související články
editovatExterní odkazy
editovat- Obrázky, zvuky či videa k tématu Hexakyanoželezitany na Wikimedia Commons