Boryleny
Boryleny jsou borité analogy karbenů.[1][2][3][4] Mají obecný vzorec R-B, kde R je organická funkční skupina B atom boru s volným elektronovým párem. Převažují u nich singletové základní stavy, kde má bor dva prázdné sp2 orbitaly a jeden dvojnásobně obsazený. Protože je na bor navázán jen jeden substituent, tak má borylenový bor větší nedostatek elektronů než uhlíkový atom v karbenech. Z tohoto důvodu jsou stabilní boryleny méně běžné než stabilní karbeny. Některé boryleny, například monofluorid boritý (BF) a monohydrid boritý (BH), také nazývaný jednoduše borylen, byly identifkovány mikrovlnnou spektroskopií a mohou se vyskytovat ve hvězdách. Další boryleny se vyskytují jako reaktivní meziprodukty a mohou být zachyceny pouze pomocí chemických pastí.
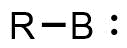
První stabilní borylenový komplex [(OC)5WBN(SiMe3)2] popsal Holger Braunschweig v roce 1998.[5][6] V této sloučenině je borylen koordinován na atom přechodného kovu. Boryleny mohou být stabilizovány také jako adukty s Lewisovými zásadami, jako jsou například NHC karbeny.[7] Další možnosti představují cyklické alkylaminokarbeny (CAAC)[8] i jiné Lewisovy zásady[9] použité jako bis-adukty.[10]
Volné boryleny editovat
Volné boryleny nebyly izolovány, jsou ovšem předměty řady výpočetních studií a zkoumány spektroskopicky i experimentálně. B-R (R = H, F, Cl, Br, I, NH2, C2H, fenyl) lze pozorovat pomocí mikrovlnné nebo imfračervené spektroskopie za nízkých teplot.[13][14][15][16] Jako reaktivní meziprodukty jsou boryleny schopny aktivovat silné jednoduché vazby C-C, přičemž se tvoří podobné produkty jako u organokovových oxidačních adicí. Nejčastějším způsobem vzniku borylenů je redukce organoborandichloridu, další možností je fotolýza jiných boranů.
Výpočty bylo zjištěno, že HOMO se skládá z nevazebných elektronů na boru (typu nσ, s hybridizací sp). LUMO a LUMO+1 jsou prázdné ortogonální orbitaly typu pπ a jsou energeticky degenerované, pokud R nenarušuje symetrii molekuly. Na rozdíl od karbenů, které se mohou vyskytovat v singletových i tripletových základních stavech mají všechny zkoumané boryleny pouze singletový základní spinový stav. Nejmenší rozdíl energie mezi singletovým a tripletovým stavem byl vypočítán na 34 kJ/mol, a to u Me3Si-B.
Výjimku z tohoto pravidla představuje aminoborylen (H2NB), u něhož volný elektronový pár na dusíku dodává elektrony do jinak neobsazeného p orbitalu boru a mezi borem a dusíkem je tak dvojná vazba; π* kombinace těchto interakcí slouží jako LUMO+1.[17]
Monostabilizované boryleny editovat
První borylen stabilizovaný jednou Lewisovou zásadou byl popsán v roce 2007; vyskytoval se jako dimer—diboren. (NHC)BBr3 adukt byl redukován, pravděpodobně na (NHC)B-H meziprodukt, který se následně dimerizoval na diboren. Byly pozorovány i jiné podobné sloučeniny s jednoduchými vazbami B-B. Diboren měl neobvykle krátké vazby mezi atomy boru b(156,0(18) pm), což naznačovalo přítomnost dvojné vazby. Byly provedeny výpočty na základě teorie funkcionálu hustoty a nevazebných orbitalů u modelového systému (s Dippovými skupinami nahrazenými atomy H). Rozdíly mezi předpovězenou a experimentálně zjištěnou krystalovou strukturou byly přičteny především narušení rovinnosti molekuly objemnými Dippovými skupinami. HOMO byl identifikován jako B-B π vazebný orbital a HOMO-1 jako směs B-H a B-B σ vazebného orbitalu. Výpočty nevazebných orbitalů tyto výsledky potvrdily, populace B-B σ- and π vazebných orbitalů jsou podle nich 1,943 a 1,382.[18]
Byla vytvořena a izolována řada podobných sloučenin a provedeny byly též studie předpokládaných monostabilizovaných borylenových meziproduktů. Izolovatelný případ byl získán až v roce 2014.[19] Betrand et al. zjistili, že díky elektropozitivitě boru a z toho vyplývající převažující chudost na elektrony vede k tomu, že CAAC (cyklický (alkyl)(amino)karben) je zde lepší Lewisovou zásadou než běžněji používaný NHC.[21] Adukt NHC a boranu byl připraven a poté redukován prostřednictvím Co(Cp*)2. Jeden ekvivalent redukčního činidla vytvořil aminoborylový radikál a druhou redukcí vznikl (CAAC)borylen.[19] Další použitou skupinou byl DAC (diamidokarben); redukce (DAC)boranového derivátu vedla k analogickému (DAC)borylenu.[20] I když má C=B=NR2 struktura podobné vlastnosti jako aminoboraalkeny, tak bylo po prozkoumání molekulových orbitalů zjištěno, jak se očekávalo, že HOMO má π symetrii vzniklou dodáním volného elektronového páru boru do prázdného orbitalu uhlíkového atomu. Volný pár dusíku předal elektrony do prázdného orbitalu boru za vzniku vazby π; kombinace těchto fází vytváří vysokoenergetický LUMO+2.[19]
První případ didusíkové fixace u prvku bloku p popsal roku 2018 Holger Braunschweig, šlo o molekulu didusíku navázanou mezi dva Lewisovou zásadou stabilizované boryleny.[22] Vzniklý dianion byl pak oxidován na neutrální sloučeninu, jež podstoupila redukci s využitím vody.
Bis-stabilizované boryleny editovat
Na základě Robinsonovy syntézy diborenu připravil Guy Bertrand v roce 2011 s využitím CAAC první bis-stabilizovaný borylen.[18][21].[24] Redukcí (CAAC)BBr3 pomocí KC8 za přítomnosti nadbytku CAAC vznikl bis(CAAC)BH. Bylo zjištěno, že proběhlo odštěpení atomu vodíku z arylu CAAC. Redukcí (CAAC)BBr3 se tvořil stejný koncový borylen i za nepřítomnosti další Lewisovy zásady; mechanismus není dosud dobře prozkoumán.[24] Tento postup byl také využit k přípravě smíšených bis-stabilizovaných borylenů.[25] Navrženo bylo i několik dalších postupů. Jeden z nich spočívá v odštěpení hydridu z (CAAC)BH3 prostřednictvím methyltriflátu. Reakcí s Lewisovou zásadou, kyselinou trifluormethansulfonovou a nakonec s KC8 vznikl konečný produkt (CAAC)(Lewisova zásada)BH.[26] I když zde byly použity pouze některé určité Lewisovy zásady, tak bylo očekáváno, že lze tento postup zobecnit.[21][26] Mnoho dalších sloučenin tohoto druhu bylo připraveno s využitím komplexů borylenů s přechodnými kovy jako prekurzorů. Působením (OC)5M=B-Tp na oxid uhelnatý či acetonitril se tvořily příslušné adukty: (CO)2B-Tp a (MeNC)2B-Tp.[27]
Vazby v těchto komplexech jsou podobné jako u monostabilizovaných. Ve všech známých příkladech je přítomen alespoň jeden π akceptorový ligand a síla vazby B-L bond závisí na π-kyselosti Lewisovy zásady. Orbitaly zde mají nízké energie σ-donace orbitalů ze zásady na bo a LUMO vytvářejí π-interakce mezi volným elektronovým párem boru a Lewisovou zásadou. Vypočtené elektronové struktury řady borylenových komplexů byly srovnány s příslušnými izoelektronickými homology: komplexy uhlíku (CL2) a dusíkových kationtů ((N+)L2).[28]
Komplexy borylenů s přechodnými kovy editovat
První komplex borylenu a přechodného kovu popsali Braunschweig et al, jednalo se o sloučeninu obsahující borylenový ligand tvořící můstek mezi dvěma manganovými centry: [μ-BX{η5-C5H4R}Mn(CO)2}2] (R = H, Me; X = NMe2).[29] První koncový borylenový komplex, [(CO)5MBN(SiMe3)2], připravila stejná skupina o několik let později. Jinými vědeckými týmy byly navrženy další dvě struktury - [(CO)4Fe(BNMe2)] a [(CO)4Fe{BN(SiMe3)2}], jejich existence však nebyla potvrzena kvůli nesrovnalostem v datech z 11B-NMR.[30] Popsán byl také velký počet diborylenových komplexů. První z nich, [(η5-C5Me5)Ir{BN(SiMe3)2}2], byl připraven fotochemickou reakcí [(η5-C5Me5)Ir(CO)2] a [(OC)5Cr{BN(SiMe3)2}].[31] Tyto komplexy se mohou účastnit neobvyklých reakcí, jako je párování borylenu a oxidu uhelnatého jako ligandu. Katenací komplexu borylenu a železa byl vytvořen komplex železa a tetraboru (B4).[32]
Interakce mezi přechodnými kovy a boryleny se podobají těm u Lewisových kyselin a borylenů. Tyto systémy byly zkoumány v řadě výpočetních studií; například v případě [(CO)4Fe{BN(SiH3)2}] bylo zjištěno, že na boru je podle očekávání nízká elektronová hustota (náboj +0,59). Vazebné π-orbitaly vazeb Fe-B mají populace 0,39 a 0,48; u vazby σ je tato hodnota 0,61. Wibergův index vazby Fe-B je tak 0,65 (například u vazby Fe-CO ve stejném komplexu činí 0,62 a v odpovídajícím komplexu wolframu 0,82. Vazby mezi přechodnými kovy a boryleny jsou tak velmi silné, mají ovšem silně iontovou povahu. Na rozdíl od příslušných komplexů kovů a karbynů byl řád vazby ve všech zkoumaných případech menší než 1.[33]
Reference editovat
- ↑ BRAUNSCHWEIG, H.; COLLING, M. The Chemistry of Borylene Complexes. Eur. J. Inorg. Chem.. 2003, s. 393–403. DOI 10.1002/ejic.200390054.
- ↑ SOLEILHAVOUP, M.; BERTRAND, G. Borylenes: An Emerging Class of Compounds. Angewandte Chemie International Edition. 2017, s. 10282–10292. DOI 10.1002/anie.201705153. PMID 28577325.
- ↑ BRAUNSCHWEIG, Holger; DEWHURST, Rian D.; GESSNER, Viktoria H. Transition metal borylene complexes. Chemical Society Reviews. 2013, s. 3197–3308. DOI 10.1039/C3CS35510A. PMID 23403460.
- ↑ BRAUNSCHWEIG, Holger; DEWHURST, Rian D.; SCHNEIDER, Achim. Electron-Precise Coordination Modes of Boron-Centered Ligands. Chemical Reviews. 2010-07-14, s. 3924–3957. ISSN 0009-2665. DOI 10.1021/cr900333n. PMID 20235583.
- ↑ BRAUNSCHWEIG, H.; KOLLANN, C.; ENGLERT, U. Synthesis and Structure of the First Terminal Borylene Complexes. Angewandte Chemie International Edition. 1998, s. 3179–3180. DOI 10.1002/(SICI)1521-3773(19981204)37:22<3179::AID-ANIE3179>3.0.CO;2-Z. PMID 29711330.
- ↑ BRAUNSCHWEIG, H; SHANG, R. Reactivity of transition-metal borylene complexes: recent advances in B-C and B-B bond formation via borylene ligand coupling. Inorg Chem. 2015, s. 3099–106. DOI 10.1021/acs.inorgchem.5b00091. PMID 25760461.
- ↑ WANG, Y; QUILLIAN, B; WEI, P; WANNERE, CS; XIE, Y; KING, RB; SCHAEFER, HF 3rd. A stable, neutral diborene containing a B=B double bond. J Am Chem Soc. 2007, s. 12412–3. DOI 10.1021/ja075932i. PMID 17887683.
- ↑ DAHCHEH, F.; MARTIN, D.; STEPHAN, D. W.; BERTRAND, G. Synthesis and Reactivity of a CAAC–Aminoborylene Adduct: A Hetero-Allene or an Organoboron Isoelectronic with Singlet Carbenes. Angewandte Chemie International Edition. 2014, s. 13159–13163. DOI 10.1002/anie.201408371. PMID 25267591.
- ↑ BRAUNSCHWEIG, Holger; DEWHURST, Rian D.; HUPP, Florian; NUTZ, Marco; RADACKI, Krzysztof; TATE, Christopher W.; VARGAS, Alfredo. Nature. 2015, s. 327–330. DOI 10.1038/nature14489. PMID 26085273. (anglicky)
- ↑ KINJO, R; DONNADIEU, B; CELIK, MA; FRENKING, G; BERTRAND, G. Synthesis and characterization of a neutral tricoordinate organoboron isoelectronic with amines. Science. 2011, s. 610–3. DOI 10.1126/science.1207573. PMID 21798945.
- ↑ GRIGSBY, Warren J.; POWER, Philip P. Isolation and Reduction of Sterically Encumbered Arylboron Dihalides: Novel Boranediyl Insertion into C−C σ-Bonds. Journal of the American Chemical Society. 1996-01-01, s. 7981–7988. ISSN 0002-7863. DOI 10.1021/ja960918j.
- ↑ MELLER, Anton; SEEBOLD, Uwe; MARINGGELE, Walter; NOLTEMEYER, Mathias; SHELDRICK, George M. Synthesis and structure of novel polycyclic species from toluene and m-xylene and the dehalogenation product of difluoro(diisopropylamino)borane. Journal of the American Chemical Society. 1989-10-01, s. 8299–8300. ISSN 0002-7863. DOI 10.1021/ja00203a052.
- ↑ BETTINGER, Holger F. Phenylborylene: Direct Spectroscopic Characterization in Inert Gas Matrices. Journal of the American Chemical Society. 2006-03-01, s. 2534–2535. ISSN 0002-7863. DOI 10.1021/ja0548642. PMID 16492027.
- ↑ ANDREWS, Lester; HASSANZADEH, Parviz; MARTIN, Jan M. L.; TAYLOR, Peter R. Pulsed laser evaporated boron atom reactions with acetylene. Infrared spectra and quantum chemical structure and frequency calculations for several novel organoborane BC2H2 and HBC2 molecules. The Journal of Physical Chemistry. 1993-06-01, s. 5839–5847. ISSN 0022-3654. DOI 10.1021/j100124a010.
- ↑ TIMMS, Peter L. Chemistry of boron and silicon subhalides. Accounts of Chemical Research. 1973-04-01, s. 118–123. ISSN 0001-4842. DOI 10.1021/ar50064a002.
- ↑ NOMOTO, Miho; OKABAYASHI, Toshiaki; KLAUS, Thomas; TANIMOTO, Mitsutoshi. Microwave spectroscopic study of the BBr molecule. Journal of Molecular Structure. 1997, s. 471–476. DOI 10.1016/s0022-2860(97)00145-2.
- ↑ KRASOWSKA, Małgorzata; EDELMANN, Marc; BETTINGER, Holger F. Electronically Excited States of Borylenes. The Journal of Physical Chemistry A. 2016-08-18, s. 6332–6341. ISSN 1089-5639. DOI 10.1021/acs.jpca.6b04502. PMID 27494640.
- ↑ a b c d e f g WANG, Yuzhong; QUILLIAN, Brandon; WEI, Pingrong; WANNERE, Chaitanya S.; XIE, Yaoming; KING, R. Bruce; SCHAEFER, Henry F. A Stable Neutral Diborene Containing a BB Double Bond. Journal of the American Chemical Society. 2007-10-01, s. 12412–12413. ISSN 0002-7863. DOI 10.1021/ja075932i. PMID 17887683.
- ↑ a b c d DAHCHEH, Fatme; MARTIN, David; STEPHAN, Douglas W.; BERTRAND, Guy. Synthesis and Reactivity of a CAAC–Aminoborylene Adduct: A Hetero-Allene or an Organoboron Isoelectronic with Singlet Carbenes. Angewandte Chemie International Edition. 2014-11-24, s. 13159–13163. ISSN 1521-3773. DOI 10.1002/anie.201408371. PMID 25267591. (anglicky)
- ↑ a b LEDET, Anthony D.; HUDNALL, Todd W. Reduction of a diamidocarbene-supported borenium cation: isolation of a neutral boryl-substituted radical and a carbene-stabilized aminoborylene. Dalton Transactions. 2016-06-14, s. 9820–9826. ISSN 1477-9234. DOI 10.1039/c6dt00300a. PMID 26843319. (anglicky)
- ↑ a b c SOLEILHAVOUP, Michele; BERTRAND, Guy. Borylenes: An Emerging Class of Compounds. Angewandte Chemie International Edition. 2017-08-21, s. 10282–10292. ISSN 1521-3773. DOI 10.1002/anie.201705153. PMID 28577325. (anglicky)
- ↑ BROERE, Daniël L. J.; HOLLAND, Patrick L. Boron compounds tackle dinitrogen. Science. 2018-02-23, s. 871. ISSN 0036-8075. DOI 10.1126/science.aar7395. PMID 29472470. (anglicky)
- ↑ a b HUANG, Pin-Qi; LAI, Chin-Hung. Computational study of unsaturated and saturated cyclic (alkyl) (amino) carbene borane complexes. Computational and Theoretical Chemistry. 2015, s. 17–23. DOI 10.1016/j.comptc.2014.10.029. (anglicky)
- ↑ a b KINJO, Rei; DONNADIEU, Bruno; CELIK, Mehmet Ali; FRENKING, Gernot. Synthesis and Characterization of a Neutral Tricoordinate Organoboron Isoelectronic with Amines. Science. 2011-07-29, s. 610–613. ISSN 0036-8075. DOI 10.1126/science.1207573. PMID 21798945. (anglicky)
- ↑ ARROWSMITH, Merle; AUERHAMMER, Dominic; BERTERMANN, Rüdiger; BRAUNSCHWEIG, Holger; BRINGMANN, Gerhard; CELIK, Mehmet Ali; DEWHURST, Rian D. Generation of Dicoordinate Boron(I) Units by Fragmentation of a Tetra-Boron(I) Molecular Square. Angewandte Chemie International Edition. 2016-11-07, s. 14464–14468. ISSN 1521-3773. DOI 10.1002/anie.201608429. PMID 27730749. (anglicky)
- ↑ a b RUIZ, David A.; MELAIMI, Mohand; BERTRAND, Guy. An efficient synthetic route to stable bis(carbene)borylenes [(L1)(L2)BH]. Chemical Communications. 2014-06-24, s. 7837–7839. ISSN 1364-548X. DOI 10.1039/c4cc03497j. PMID 24909943. (anglicky)
- ↑ BRAUNSCHWEIG, Holger; DEWHURST, Rian D.; HUPP, Florian; NUTZ, Marco; RADACKI, Krzysztof; TATE, Christopher W.; VARGAS, Alfredo. Multiple complexation of CO and related ligands to a main-group element. Nature. June 2015, s. 327–330. ISSN 1476-4687. DOI 10.1038/nature14489. PMID 26085273.
- ↑ CELIK, Mehmet Ali; SURE, Rebecca; KLEIN, Susanne; KINJO, Rei; BERTRAND, Guy; FRENKING, Gernot. Borylene Complexes (BH)L2 and Nitrogen Cation Complexes (N+)L2: Isoelectronic Homologues of Carbones CL2. Chemistry – A European Journal. 2012-04-27, s. 5676–5692. ISSN 1521-3765. DOI 10.1002/chem.201103965. PMID 22434609. (anglicky)
- ↑ BRAUNSCHWEIG, Holger; WAGNER, Trixie. Synthesis and Structure of the First Transition Metal Borylene Complexes. Angewandte Chemie International Edition in English. 1995-04-13, s. 825–826. ISSN 1521-3773. DOI 10.1002/anie.199508251. (anglicky)
- ↑ BRAUNSCHWEIG, Holger; KOLLANN, Carsten; ENGLERT, Ulli. Synthesis and Structure of the First Terminal Borylene Complexes. Angewandte Chemie International Edition. 1998-12-04, s. 3179–3180. ISSN 1521-3773. DOI 10.1002/(sici)1521-3773(19981204)37:22<3179::aid-anie3179>3.0.co;2-z. PMID 29711330. (anglicky)
- ↑ BERTSCH, Stefanie; BRAUNSCHWEIG, Holger; CHRIST, Bastian; FORSTER, Melanie; SCHWAB, Katrin; RADACKI, Krzysztof. Towards Homoleptic Borylene Complexes: Incorporation of Two Borylene Ligands into a Mononuclear Iridium Species. Angewandte Chemie International Edition. 2010-12-03, s. 9517–9520. ISSN 1521-3773. DOI 10.1002/anie.201004103. PMID 21053226. (anglicky)
- ↑ BRAUNSCHWEIG, Holger; SHANG, Rong. Reactivity of Transition-Metal Borylene Complexes: Recent Advances in B–C and B–B Bond Formation via Borylene Ligand Coupling. Inorganic Chemistry. 2015-04-06, s. 3099–3106. ISSN 0020-1669. DOI 10.1021/acs.inorgchem.5b00091. PMID 25760461.
- ↑ UDDIN, Jamal; BOEHME, Christian; FRENKING, Gernot. Nature of the Chemical Bond between a Transition Metal and a Group-13 Element: Structure and Bonding of Transition Metal Complexes with Terminal Group-13 Diyl Ligands ER (E = B to Tl; R = Cp, N(SiH3)2, Ph, Me). Organometallics. 2000-02-01, s. 571–582. ISSN 0276-7333. DOI 10.1021/om990936k.