Roussinova červená sůl
Roussinova červená sůl je anorganická sloučenina se vzorcem K2[Fe2S2(NO)4]. Tento nitrosylový komplex objevil Zacharie Roussin v roce 1858.[1][2]
| Roussinova červená sůl | |
|---|---|
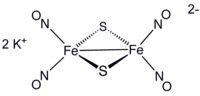 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | tetranitrosyl-di-μ-sulfidodi(Fe-Fe)železnatan draselný |
| Sumární vzorec | Fe2N4K2S2O4 |
| Vzhled | tmavě červené krystaly |
| Identifikace | |
| Registrační číslo CAS | 58204-17-4 |
| PubChem | 162850 |
| SMILES | [K+].[O+]%23[N+][Fe-5]([N%2B]%23[O%2B])12S[Fe-5]([N%2B]%23[O%2B])([N%2B]%23[O%2B])1S2.[K+] |
| InChI | InChI=1S/2Fe.4NO.2S/c;;4*1-2;;/q;;4*+1;2*-2 |
| Vlastnosti | |
| Molární hmotnost | 374,04 g/mol |
Některá data mohou pocházet z datové položky. | |
Struktura
editovatAnion této soli vytváří dvojitý čtyřstěn, kde obě jeho části mají společný vrchol a dvojice Fe(NO)2 jednotek je spojena dvěma sulfidovými můstky. Vazby Fe-NO jsou lineární, což naznačuje, že je NO donorem tří elektronů.[3] Sloučenina je diamagnetická a odpovídá pravidlu 18 elektronů. Tmavě červenou barvu způsobují interakce mezi železnatým jádrem a nitrosylovými ligandy.[4]
Příprava
editovatZ. Roussin vytvořil tuto sůl při zkoumání reakcí nitroprusidového iontu ([Fe(CN)5NO]2−) se sírou.[1][5] Získat ji lze také reakcemi sulfidů s nitrosylhalogenidy železa:[6]
- Fe2I2(NO)4 + 2Li2S → Li2Fe2S2(NO)4 + 2LiI
Alkylací soli vznikají „estery“:
- Li2Fe2S2(NO)4 + 2 RX → Fe2(SR)2(NO)4 + 2 LiX
Estery se také dají připravit reakcemi Fe2I2(NO)4 s thioly.
Výskyt a využití
editovatV přírodě se tato sůl vyskytuje v podobě „esterů“ se vzorcem Fe2(SR)2(NO)4, kde R ke alkylová skupina.[3] Roussinova červená sůl je také zkoumána v mikrobiologii a potravinových vědách, protože se jedná o mutagen.[7]
„Estery“ se zkoumají v biologii a lékařství jako zdroje oxidu dusnatého, kde se využívá toho, že se Roussinova červená sůl vyznačuje stabilitou a nízkou toxicitou.[8]
Odkazy
editovatReference
editovatV tomto článku byl použit překlad textu z článku Roussin's red salt na anglické Wikipedii.
- ↑ a b Anthony R. Butler. The chemist Z. Roussin (1827-94). Journal of Chemical Education. 1982, s. 549. DOI 10.1021/ed059p549. Bibcode 1982JChEd..59..549B.
- ↑ M. L. Roussin. Recherches sur les nitrosulfures doubles de fer (nouvelle classe de sels). Annales de chimie et de physique. 1858, s. 285–303. Dostupné online.
- ↑ a b J. T. Thomas; J. H. Robertson; E. G. Cox. The crystal structure of Roussin's red ethyl ester. Acta Crystallographica. 1958, s. 599–604. DOI 10.1107/S0365110X58001602.
- ↑ Maria Jaworska; Zofia Stasicka. Structure and UV-Vis spectroscopy of the iron-sulfur dinuclear nitrosyl complexes [Fe2S2(NO)4]2− and [Fe2(SR)2(NO)4. New Journal of Chemistry. 2005, s. 604. DOI 10.1039/B409519G.
- ↑ Hans Reihlen; Adolf v. Friedolsheim. Über komplexe Stickoxydverbindungen und das sogenannte einwertige Eisen. Justus Liebigs Annalen der Chemie. 1927, s. 71–82. Dostupné online. DOI 10.1002/jlac.19274570103.
- ↑ T. B. Rauchfuss; T. D. Weatherill. Roussin's Red Salt revisited: reactivity of Fe2 (μ-E) 2 (NO) 42-(E= S, Se, Te) and related. Inorganic Chemistry. 1982, s. 827–830. DOI 10.1021/ic00132a071.
- ↑ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4
- ↑ H. Yoon; S. Park; M. Lim. Photorelease Dynamics of Nitric Oxide from Cysteine-Bound Roussin's Red Ester. The Journal of Physical Chemistry Letters. 2020, s. 3198–3202. Dostupné online. DOI 10.1021/acs.jpclett.0c00739. PMID 32250631.
Související články
editovatExterní odkazy
editovat- Obrázky, zvuky či videa k tématu Roussinova červená sůl na Wikimedia Commons