Fluorid zlatitý
Fluorid zlatitý je anorganická sloučenina s chemickým vzorcem AuF3.
| Fluorid zlatitý | |
|---|---|
 | |
| Obecné | |
| Systematický název | Fluorid zlatitý |
| Anglický název | Gold(III) fluoride |
| Německý název | Gold(III)-fluorid |
| Sumární vzorec | AuF3 |
| Vzhled | oranžovožluté krystaly |
| Identifikace | |
| Registrační číslo CAS | 14720-21-9 |
| PubChem | 5460532 |
| SMILES | F[Au](F)F |
| InChI | InChI=1S/Au.3FH/h;3*1H/q+3;;;/p-3
Key: NIXONLGLPJQPCW-UHFFFAOYSA-K |
| Vlastnosti | |
| Molární hmotnost | 253,96 g/mol |
| Teplota tání | sublimuje nad 300 °C |
| Hustota | 6,75 g/cm3 |
| Rozpustnost ve vodě | reaguje s vodou |
| Měrná magnetická susceptibilita | +74·10−6 cm3/mol |
| Struktura | |
| Krystalová struktura | hexagonální |
| Hrana krystalové mřížky | a = 515,08 pm, c = 1626,369 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −363,3 kJ·mol−1 |
Některá data mohou pocházet z datové položky. | |
Příprava
editovatFluorid zlatitý lze připravit fluorací zlata přebytkem fluoru:[1]
- 2 Au + 3 F2 → 2 AuF3
Fluorid zlatitý vzniká také reakcí zlata s fluoridem bromitým.[1]
Lze jej také připravit pyrolýzou fluoridu zlatičného za teploty 200 °C.[2]
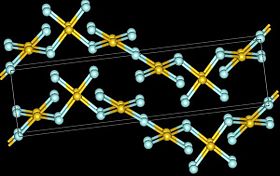
Struktura
editovatKrystalová struktura fluoridu zlatitého se skládá ze spirál čtvercově rovinných jednotek AuF4,[3] které jsou spojeny se dvěma dalšími jednotkami. Vzniká tak deformovaný oktaedr AuF6. Krystalická struktura je typu fluoridu stříbřitého (hexagonální soustava, prostorová grupa P6122 (Číslo 178)).[2]
| elementární buňka AuF3 | šroubovice (AuF3)n | deformovaná oktaedrická koordinace zlata šesti atomy fluoru | pohled shora na šroubovici (AuF3)n | boční pohled na šroubovici (AuF3)n |
Vlastnosti
editovatFluorid zlatitý je diamagnetická oranžovožlutá pevná látka,[4] která se rozkládá při 500 °C. S fluoridovými ionty tvoří fluorid zlatitý ionty [AuF4]− a [Au2F7]−. Iont [AuF4]− se vyskytuje v Au3F8.[5]
Využití
editovatOdkazy
editovatReference
editovatV tomto článku byly použity překlady textů z článků Gold(III) fluoride na anglické Wikipedii a Gold(III)-fluorid na německé Wikipedii.
- ↑ a b TORNIEPORTH‐OETTING, Inis C.; KLAPÖTKE, Thomas M. Laboratory Scale Direct Synthesis of Pure AuF 3. Chemische Berichte. 1995-09, roč. 128, čís. 9, s. 957–958. Dostupné online [cit. 2024-01-09]. ISSN 0009-2940. DOI 10.1002/cber.19951280918. (anglicky)
- ↑ a b RIEDEL, Erwin; JANIAK, Christoph. Anorganische Chemie. [s.l.]: Walter de Gruyter 980 s. Dostupné online. ISBN 978-3-11-022567-9. S. 759. (německy)
- ↑ EINSTEIN, F. W. B.; RAO, P. R.; TROTTER, James. The crystal structure of gold trifluoride. Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1967, s. 478. Dostupné online [cit. 2024-01-09]. ISSN 0022-4944. DOI 10.1039/j19670000478. (anglicky)
- ↑ PERRY, Dale L. Handbook of Inorganic Compounds. [s.l.]: CRC Press 584 s. Dostupné online. ISBN 978-1-4398-1462-8. S. 191. (anglicky)
- ↑ SCHMIDT, R.; MÜLLER, B. G. Einkristalluntersuchungen an Au[AuF4]2 und CeF4, zwei unerwarteten Nebenprodukten. Zeitschrift für anorganische und allgemeine Chemie. 1999-04, roč. 625, čís. 4, s. 605–608. Dostupné online [cit. 2024-01-09]. ISSN 0044-2313. DOI 10.1002/(SICI)1521-3749(199904)625:4<605::AID-ZAAC605>3.0.CO;2-6. (německy)
- ↑ ROESKY, Herbert W. Efficient Preparations of Fluorine Compounds. [s.l.]: Wiley 485 s. Dostupné online. ISBN 978-1-118-40942-8. S. 96. (anglicky)
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Fluorid zlatitý na Wikimedia Commons