Flavinmononukleotid
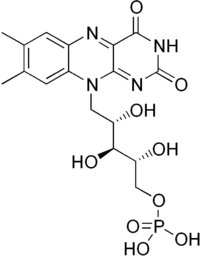
Flavinmononukleoktid (FMN, riboflavin-5'-fosfát) je biomolekula produkovaná z riboflavinu (vitamin B2) enzymem riboflavinkinázou a funguje jako kofaktor nebo protetická skupina [2] různých oxidoreduktáz (včetně NADH dehydrogenázy). Jako oxidačně-redoxně[3] aktivní sloučenina je řazena mezi flavinové nukleotidy.[1] Od příbuzné sloučeniny flavinadenindinukleotid (FAD) se liší nepřítomností adenosinmonofosfátu (AMP).
| Flavinmononukleoktid | |
|---|---|
 | |
| Obecné | |
| Systematický název | oxidovaný: 7,8-dimethyl-10-(5-fosfo-D-ribityl)isoalloxazin redukovaný: (dihydroriboflavin-5′-fosfát)-1,5-dihydro-7,8-dimethyl-10-(5-fosfo-D-ribityl) isoalloxazin[1] |
| Triviální název | Flavinmononukleoktid |
| Sumární vzorec | C17H21N4O9P |
| Identifikace | |
| Registrační číslo CAS | 146-17-8 |
| Vlastnosti | |
| Molární hmotnost | 456,344 g/mol |
Některá data mohou pocházet z datové položky. | |
Přestože se FMN nazývá flavinmononukleotid, nejedná o nukleotid. Isoalloxazinový skelet není navázán na ribózu, ale na ribitol, a spojení není realizováno glykosidovou vazbou.
FMN je oxidačně-redoxně aktivní sloučenina, která přechází z oxidované chinonové (FMN) přes semichinonovou formu (FMNH•) na hydrochinonovou formu (FMNH•). Existence tří oxidačních stavů je důležitá pro propojení různých oxidačně-redukčních drah. K redukci dochází na dvou dusíkových atomech v heterocyklických kruzích flavinu. FMN je silnější oxidační činidlo než NAD a je zvláště užitečný, protože se může účastnit přenosů jednoho i dvou elektronů.
FMN je součástí flavoproteinů a je kofaktorem například v komplexu I (NADH dehydrogenáza) v dýchacím řetězci. V roce 1937 obdržel Paul Karrer Nobelovu cenu za svou základní práci o skupině látek flavinů.
Výskyt editovat
FMN je hlavní forma, ve které se riboflavin nachází v buňkách a tkáních. Vyžaduje více energie ke svému vzniku, ale je rozpustnější než riboflavin. V buňkách se FMN vyskytuje volně cirkulující, ale také v několika kovalentně vázaných formách. Kovalentně nebo nekovalentně vázané FMN je kofaktorem mnoha enzymů, které hrají důležitou patofyziologickou roli v buněčném metabolismu. Například bylo prokázáno, že disociace FMN od mitochondriálního komplexu I se vyskytuje během ischemie mozku.
Chemické složení editovat
Flavinové koenzymy a tedy i FMN se odvozují od riboflavinu. FMN (riboflavin-5‘-fosfát) tak vzniká po fosforylaci riboflavinu. Název není přesný, protože se nejedná o nukleotid v pravém slova smyslu (nejedná se o N-glykosid ribózafosfátu), ale o derivát ribitolu. Protože se však název i zkratka obecně vžily, je toto označení používáno i nadále.
Mechanismus působení editovat
FMN může katalyzovat reakce probíhající jak iontovým mechanismem (dvouelektronové reakce), tak i mechanismem radikálovým (jednoelektronové reakce).
Isoalloxazinový systém, který je součástí FMN, funguje jako reverzibilní redoxní systém. Vodíky se vážou na dusíky N1 a N5 v tomto cyklu.
Stejně jako u nikotinamidových koenzymů lze hydrogenační reakce i v případě flavinových koenzymů odvozovat od hypotetického hydridového iontu, který se chová jako nukleofilní činidlo a je schopen se nejen navázat na oxidovaný koenzym a tím ho redukovat, ale také se případně od redukovaného koenzymu odštěpit.
Potravinářská přídatná látka editovat
- FMN se používá jako oranžovo-červená potravinářská přídatná látka, označená v Evropě jako číslo E E101a.
- Příbuzná potravinářská přídatná látka E106 je sodná sůl riboflavin-5′-fosfátu. Po požití se rychle změní na volný riboflavin. Nachází se v mnoha potravinách pro kojence a malé děti, stejně jako džemy, mléčné výrobky a sladkosti a cukrové výrobky.
Reference editovat
V tomto článku byly použity překlady textů z článků Flavinmononukleotid na německé Wikipedii a Flavin mononucleotide na anglické Wikipedii.
- ↑ a b Oxford dictionary of biochemistry and molecular biology; revised edition. Příprava vydání R. Cammack et al. New York: Oxford university press, 2006. ISBN 0-19-852917-1.
- ↑ VODRÁŽKA, Zdeněk; RAUSCH, Pavel; KÁŠ, Jan. Enzymologie. [s.l.]: VŠCHT v Praze, 1998.
- ↑ VOET, Donald; VOET, Judith. Biochemie. 1.. vyd. Praha: Victoria Publishing, 1995. ISBN 80-85605-44-9.
Související články editovat
Externí odkazy editovat
- Obrázky, zvuky či videa k tématu flavinmononukleotid na Wikimedia Commons