Boyleův–Mariottův zákon
Boyleův–Mariottův zákon, zvaný též Boyleův zákon je termodynamický vztah pro izotermický děj probíhající v ideálním plynu stálé teploty.
Rovnice editovat
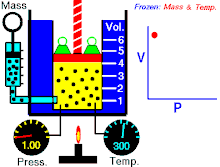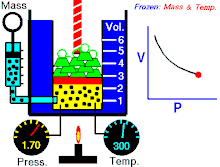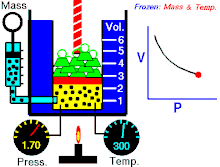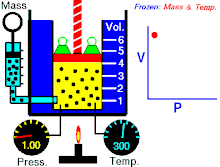
Boyleův–Mariottův zákon říká, že součin tlaku a objemu plynu je stálý, tedy
- ,
kde p je tlak plynu a je objem daného množství plynu. Hodnota konstanty závisí na množství plynu a jeho teplotě a podle stavové rovnice ideálního plynu je pro danou teplotu rovna , kde n je látkové množství plynu, R je molární plynová konstanta a T je absolutní teplota plynu.
Zápis zákona se tak změní v běžně používaný tvar stavové rovnice ideálního plynu, tzn.
Vlastnosti editovat
Boyleův–Mariottův zákon je platný pro ideální plyn. U reálného plynu však mohou (zejména při nízkých nebo naopak velmi vysokých teplotách) nastat značné odchylky od tohoto zákona, zejména vzhledem k tomu, že v ideálním plynu nejsou uvažovány žádné mezimolekulové síly (tvorba vicemolekulových komplexů při nízkých teplotách) ani změny chemického složení s teplotou (disociace molekul při vysokých teplotách. Teplota, při které se součin p.V se změnou tlaku nemění, se nazývá Boyleova teplota.)
Historická poznámka editovat
Boyleův–Mariottův zákon formuloval roku 1662 irský přírodovědec Robert Boyle. Podle některých historiků vědy však velmi pravděpodobně jeho exaktní matematickou formulaci nevypracoval sám Boyle (vzhledem k jeho menším znalostem matematiky), ale spíše jeho asistent Robert Hooke. Ten také vyvinul vývěvu, potřebnou k experimentálnímu ověření tohoto vztahu. Nezávisle na nich dospěl ke stejnému zjištění v roce 1676 i francouzský fyzik Edme Mariotte.
Boyleův–Mariottův zákon je historicky prvním zákonem, popisující izoproces ideálního plynu (v tomto případě izotermický děj). I když se tepelnou roztažností vzduchu zabýval již Guillaume Amontons (*1663, rok po objevu Boyleova zákona), první přesné měření publikovali až v roce 1802 nezávisle na sobě Joseph Louis Gay-Lussac a John Dalton.)
Další zákony editovat
- Gay-Lussacův zákon popisuje lineární závislost objemu ideálního plynu na jeho teplotě při konstantním tlaku – izobarický proces. Konstanta úměrnosti se nazývá teplotní objemová roztažnost při konstantním tlaku .
- Charlesův zákon říká, že tlak plynu je přímo úměrný jeho termodynamické teplotě při konstantním objemu, tudíž popisuje izochorický děj a konstanta úměrnosti se nazývá teplotní rozpínavost při konstantním objemu .
Všechny výše uvedené zákony popisují chování konstantního množství plynu. Při ději se nemění počet částic. Zákon tvrdící, že ve stejných objemech plynů při stejné teplotě a stejném tlaku je obsažen vždy stejný počet částic, se nazývá Avogadrův zákon. Konstantní počet částic v jednotkovém objemu za normální teploty a normálního tlaku je popsán Loschmidtovým číslem. V důsledku platnosti Avogadrova zákona mohla být určena molární plynová konstanta R.
Zobecněním všech uvedených čtyř zákonů spolu se znalostí plynové konstanty R bylo možné dospět k formulaci stavové rovnice ideálního plynu. Stalo se tak více než sto let po objevu Boyleova–Mariottova zákona. Bylo to tím, že ve fyzice jednak trvalo poměrně dlouhou dobu, než se podařilo vůbec odlišit pojmy teplo a teplota, dlouho též trvalo dospět k pojmu absolutní teploty. Gay-Lussac, Dalton i Charles formulovali své zákony ještě v době, kdy pojem absolutní teploty nebyl znám, a proto tvar jejich zákonů měl složitější tvar než dnes. Sir William Thomson alias Lord Kelvin, který tyto věci vyřešil, se narodil až v roce 1824.
Související články editovat
Externí odkazy editovat
- Obrázky, zvuky či videa k tématu Boyleův-Mariottův zákon na Wikimedia Commons